ERIKA LORENA VALENCIA MARTÍNEZ
10-1
DOCENTE: DIANA JARAMILLO
QUÍMICA
INSTITUCIÓN EDUCATIVA TÉCNICA EXALUMNAS DE LA PRESENTACIÓN
IBAGUÉ
2019
REACCIONES EN EQUILIBRIO
INTRODUCCIÓN
Los procesos químicos evolucionan desde los reactivos hasta la formación de productos a una determinada velocidad hasta que la reacción se completa. Llegado este punto, lo que ocurre en el proceso es que la velocidad de formación de los productos es igual a la velocidad de descomposición de éstos para formar nuevamente los reactivos de los que proceden. Es decir, se llega a la formación de un estado dinámico en el que las concentraciones de todas las especies reaccionantes (reactivos y productos) permanecen constantes.
OBJETIVOS
- Conocer las diferentes estrategias o procedimientos que se llevaron a cabo en el laboratorio para obtener una reacción en equilibrio.
- Reconocer los materiales o implementos de laboratorio utilizados.
- Observar los cambios que se presentaron en cada reacción.
- Identificar los compuestos que se producen al formar las sustancias.
MARCO TEÓRICO
El equilibrio químico es un estado de un sistema reaccionante en el que no se observan cambios a medida que transcurre el tiempo, a pesar de que la reacción sigue. Es decir, se establece cuando existen dos reacciones opuestas que tienen lugar simultáneamente a la misma velocidad.Así pues, si tenemos una reacción:
Vd=Velocidad de formación de los productos
Vi=Velocidad de descomposición de los productos
Se puede deducir que el sistema evolucionará cinéticamente, en uno u otro sentido, con el fin de adaptarse a las condiciones energéticas más favorables. Cuando éstas se consigan, diremos que se ha alcanzado el equilibrio.
⧍G=0
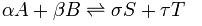
Un equilibrio químico puede ser representado de la siguiente manera:
Siendo A y B, los reactivos, S y T los productos, y las letras griegas delante de cada uno, sus respectivos coeficientes estequiométricos.
La constante del equilibrio K puede definirse como siendo la relación entre el producto entre las concentraciones de los productos (en el equilibrio) elevadas a sus correspondientes coeficientes estequiométricos, y el producto de las concentraciones de los reactivos (en el equilibrio) elevadas en sus correspondientes coeficientes estequiométricos. Esta constante sufre variaciones con la temperatura.
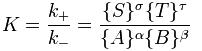
Existen varios factores que pueden alterar el estado de equilibrio químico, los más importantes son la temperatura, la presión y la concentración de los reactivos o productos.
Un ejemplo concreto de equilibrio químico, el ácido acético disuelto en agua y la formación de iones acetato e hidronio:
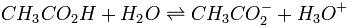
Donde la constante de equilibrio estaría dada por la siguiente fórmula:
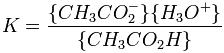
DESARROLLO
EQUILIBRIO (CLORURO DE AMONIO)
INTRODUCCIÓN
En este ejemplo de equilibrio químico aprenderemos la definición, proceso, y el resultado que se obtiene del cloruro de amonio.
OBJETIVOS
- Identificar que tipo de implementos o materiales se utilizaron para este.
- Cual fue el resultado y la reacción de este equilibrio químico.
MARCO TEÓRICO
El cloruro de amonio son partículas blancas higroscópicas finamente divididas e inodoras.
Tambien es mas conocida como sal inorgánica que se encuentra en la orina cuya fórmula es NH4Cl. Se encuentra en formaciones mineralógicas y en esta forma se llama sal amoníaco. También se ha encontrado en algunos respiraderos volcánicos y cenizas.
El cloruro de amonio es soluble en agua, formando un ácido débil. Su solubilidad aumenta con la temperatura según la siguiente informacion:
A cero grado 29.7 gr. de cloruro de amonio en 100 gr de agua
A veinte grados 54.6 gr de cloruro de amonio en 100 gr de agua
A ochenta grados 66.1 gr de cloruro de amonio en 100 gr de agua
A cien grados 73.0 gr de cloruro de amonio en 100 gr de agua
Puede obtenerse por diversos métodos. El primero es a través de la neutralización con HCl del residuo amoniacal formado en la destilación del carbón: NH3 + HCl → NH4Cl.
También es soluble en etanol, metanol y glicerol y ligeramente soluble en acetona.

NH3 + CO2 + NaCl + H2O → NH4Cl + NaHCO3
En el proceso Solvay, el bicarbonato de sodio se recupera por filtración y luego el cloruro de amonio que permanece en solución cristaliza (Ammonium Chloride Formula, S.F.).
Las soluciones resultantes contienen concentraciones moderadas de iones hidronio y tienen un pH inferior a 7,0. Reaccionan como ácidos para neutralizar bases.
Por lo general, no reaccionan como agentes oxidantes o agentes reductores, pero tal comportamiento no es imposible. Muchos de estos compuestos catalizan reacciones orgánicas.
El cloruro de amonio se descompone si es sometido a altas temperaturas, liberando humos tóxicos e irritantes, como amoníaco, óxidos de nitrógeno y cloruro de hidrógeno.
DESARROLLO
MOLES Y MASAS
INTRODUCCIÓN
Conocer el concepto de mol y de masa
OBJETIVOS
Es
MARCO TEÓRICO
Mol
DESARROLLO
FALTÓ INFORME DE LOS OTROS LABORATORIOS Y LOS QUE HIZO LE QUEDÓ INOMPLETO
ResponderEliminar3,3