
GRUPOS 4A - 5A - 6A - 7A DE LA TABLA PERIÓDICA
ERIKA LORENA VALENCIA MARTÍNEZ
11-1
INSTITUCIÓN EDUCATIVA TÉCNICA EXALUMNAS DE LA PRESENTACIÓN
IBAGUÉ - TOLIMA
INTRODUCCIÓN
El siguiente trabajo es elaborado con el fin de proporcionar información a cerca de la tabla periódica, su clasificación, explicación de algunos de sus grupos y elementos como los grupos IVA, VA, VIA, VIIA con sus respectivas características, propiedades físicas y químicas, usos, etc.
A continuación, en la tabla periódica veremos a cada uno de estos elementos representados por un determinado símbolo, símbolo que tendrá a su costado dos pequeños números, uno arriba de otro: el de abajo remitirá al número atómico, a la susodicha cantidad de protones, mientras que el de arriba hará referencia al número másico, a la suma de protones y de neutrones que exista en el núcleo del átomo en cuestión.
Hoy en día, es un elemento fundamental para cualquier persona que se esté formando en ciencias duras.
OBJETIVOS
- Reconocer e identificar cada uno de los elementos de los grupos 4A - 5A - 6A - 7A.
- Indagar sobre cada uno de los grupos (4A - 5A - 6A - 7A) y elementos que corresponden a estos.
- Identificar las características, propiedades físicas y químicas y usos de cada uno de los grupos y/o elementos que se encuentran en el medio en el que habitamos.
MARCO TEÓRICO
¿QUÉ ES LA TABLA PERIÓDICA?
La tabla Periódica es una herramienta gráfica en la que figuran todos los elementos químicos conocidos por la humanidad, organizados conforme al número de protones de sus átomos, también llamado número atómico, y tomando en cuenta también la configuración de sus electrones y las propiedades químicas específicas que presentan.
Los elementos que se comportan de manera semejante ocupan renglones cercanos, y se identifican en grupos (columnas, dieciocho en total) y períodos (filas, siete en total).


También, están representados con sus respectivos símbolos químicos, y a través de un sistema de colores que indica el estado de agregación del elemento a una temperatura de 0 °C y una presión de 1 atmósfera: rojo (gaseoso), azul (líquido), negro (sólido) y gris (desconocido).
A continuación los grupos A 4,5,6, y 7 de la tabla periódica:
GRUPO IV A

Grupo IVA o Grupo 14 en la Tabla Periódica de los Elementos, son un grupo de elementos conocido como Grupo del Carbono, más conocido por el nombre de los Carbonoideos.
El grupo está formado por:
- Carbono (C)
- Silicio (Si)
- Germanio (Ge)
- Estaño (Sn)
- Plomo (Pb)
- Flevorio (Fl)
Estos elementos forman más de la cuarta parte de la corteza terrestre y solo podemos encontrar en forma natural al carbono al estaño y al plomo en forma de óxidos y sulfuros, su configuración electrónica termina en ns2,p2. Los elementos de este grupo presenta diferentes estados de oxidación y estos son: +2 y +4., los compuestos orgánicos presentan variedad en su oxidación. Estos elementos no suelen reaccionar con el agua, los ácidos reaccionan con el germanio, estaño y plomo, las bases fuertes atacan a los elementos de este grupo, con la excepción del carbono, desprendiendo hidrógeno, reaccionan con el oxígeno formando óxidos.
Los elementos pertenecientes a esta familia son químicamente estables, poco reactivos. Pero son capaces de formar hidruros y halogenuros. Además, los elementos tienden a formar enlaces covalentes; aunque el estaño y el plomo (ambos metales) tienden a formar enlaces metálicos.
Mientras que los óxidos de carbono y silicio son ácidos, los del estaño y plomo son anfótero, el plomo es un elemento tóxico.
Estos elementos no suelen reaccionar con el agua, los ácidos reaccionan con el germanio, estaño y plomo, las bases fuertes atacan a los elementos de este grupo, con la excepción del carbono, desprendiendo hidrógeno, reaccionan con el oxígeno formando óxidos.
Estos elementos no suelen reaccionar con el agua, los ácidos reaccionan con el germanio, estaño y plomo, las bases fuertes atacan a los elementos de este grupo, con la excepción del carbono, desprendiendo hidrógeno, reaccionan con el oxígeno formando óxidos.
CARACTERÍSTICAS
- Punto de fusión
- Carbono: 3.500 ºC (diamante).
- Silicio: 1.410 ºC.
- Geranio: 937,4 ºC.
- Estaño: 231,88 ºC.
- Plomo: 327,50 ºC.
- Carbono: 4.827 ºC (diamante).
- Silicio: 2.355 ºC.
- Germanio: 2.830 ºC.
- Estaño: 2.260 ºC.
- Plomo: 1.740 ºC.
- Carbono: 3,51 g/cm3 (diamante).
- Silicio: 2,33 g/cm3.
- Germanio: 5,327 g/cm3.
- Estaño: 7,28 g/cm3.
- Plomo: 11,343 g/cm3.
- Energía de ionización
- Carbono: 1.086 kJ/mol.
- Silicio: 787 kJ/mol.
- Germanio: 762 kJ/mol.
- Estaño: 709 kJ/mol.
- Plomo: 716 kJ/mol.
- Radio atómico
- Carbono: 77 pm.
- Silicio: 118 pm.
- Germanio: 122 pm.
- Estaño: 140 pm.
- Plomo: 175 pm.
Los valores de los puntos de fusión y ebullición de los elementos del grupo 14 tienden a disminuir a medida que aumentan su número y radio atómico.
PROPIEDADES QUÍMICAS
PROPIEDADES QUÍMICAS
- No reaccionan con el agua.
- El germanio, estaño y plomo son atacados por los ácidos.
- Son atacados por disoluciones alcalinas desprendiendo hidrógeno, a excepción del elemento carbono.
- Reaccionan con el oxígeno formando óxidos. Siendo los óxidos de carbono y silicio ácidos, el de estaño anfótero (es decir, que reacciona con ácidos y bases calientes) y lo mismo sucede con el plomo.
- Al formar hidruros presentan la habilidad de formar concatenación. La concatenación es la propiedad que poseen algunos elementos de unirse con otro átomo del mismo elemento para formar cadenas ya sea lineales ramificadas o cíclicas. Esta predisposición disminuye al descender en el grupo.
- La concentración se le atribuye al elemento carbono, aunque también es un fenómeno suscitado en el silicio. Este fenómeno es la raíz de la química orgánica.
PROPIEDADES FÍSICAS
- El primer elemento del grupo, el carbono es un no metal duro y sólido a temperatura ambiente. Este elemento puede encontrarse en la naturaleza en forma de carbono amorfo (grafito) y en forma de diamante. Ambas formas alotrópicas poseen coloraciones distintas, siendo el grafito de color negro y el diamante incoloro.
- Los elementos silicio y germanio, son los metaloides del grupo, y presentan una dureza intermedia. El silicio posee propiedades intermedias entre el carbono y el germanio. Su forma cristalina es bastante dura y muestra un brillo metálico de color grisáceo.
- El metaloide germanio es de color blanco grisáceo lustroso, quebradizo y conserva el brillo a temperaturas normales. Este elemento exhibe la misma estructura cristalina que el diamante.
- Los metales de este grupo son el estaño y el plomo. El estaño es de color plateado y maleable. Por su parte, el plomo es un metal pesado que rara vez se encuentra en estado elemental. Es de color plateado con tono azulado, que se empaña para adquirir un color gris mate. Es flexible, inelástico y se funde con facilidad.
- Los puntos de fusión y ebullición son menores a medida de que se desciende en el grupo. Esto debido a que se pierde la fuerza de enlace entre los átomos.
Ejemplo:

Estaño blanco se convierte en estaño gris después de
enfriarse a menos de 13 °C
- CARBONO

Es un elemento químico de número atómico 6, es un sólido a temperatura ambiente. Es el pilar básico de la química orgánica; se conocen cerca de 16 millones de compuestos de carbono, aumentando este número en unos 500.000 compuestos por año, y forma parte de todos los seres vivos conocidos. Forma el 0,2 % de la corteza terrestre.
El carbono se encuentra presente en carbohidratos, lípidos, proteínas y ácidos nucleicos; es decir, en todas las moléculas y macromoléculas responsables de la vida. Sin embargo, es el decimoséptimo elemento en abundancia en la corteza terrestre.
Es el único elemento de la familia que se encuentra en la corteza terrestre en forma pura. Además, se combina con otros elementos para formar petróleo y carbonatos en rocas como la calcita (CaCO3), la magnesita (MgCO3) y la dolomita (MgCO3·CaCO3).
Es el único elemento de la familia que se encuentra en la corteza terrestre en forma pura. Además, se combina con otros elementos para formar petróleo y carbonatos en rocas como la calcita (CaCO3), la magnesita (MgCO3) y la dolomita (MgCO3·CaCO3).
El carbono amorfo es polvo negro en forma de hollín. En el fullereno, los anillos de carbono forman arreglos moleculares semejantes a balones de futbol. Y en el grafeno, encontramos una capa de átomos de carbono dispuestos en forma de panal de abejas.
CARACTERÍSTICAS
PROPIEDADES






 El estaño es un elemento químico de aspecto gris plateado brillante con número atómico 50. Su símbolo es Sn y pertenece al grupo de los metales del bloque p y su estado habitual en la naturaleza es sólido. El estaño está situado en la posición 50 de la tabla periódica.
El estaño es un elemento químico de aspecto gris plateado brillante con número atómico 50. Su símbolo es Sn y pertenece al grupo de los metales del bloque p y su estado habitual en la naturaleza es sólido. El estaño está situado en la posición 50 de la tabla periódica.


 Es un metal de número atómico 82 y peso atómico 207,2 g/mol. Tiene una estructura cristalina centrada en las caras, color blanco azulado, y gran toxicidad para el hombre. El plomo se encuentra formando parte del mineral galena (PbS). El plomo forma aleaciones con muchos metales, y, en general, se emplea en esta forma en la mayor parte de sus aplicaciones. Todas las aleaciones formadas con estaño, cobre, arsénico, antimonio, bismuto, cloro, cloroformo, esteres, cadmio y sodio tienen importancia industrial.
Es un metal de número atómico 82 y peso atómico 207,2 g/mol. Tiene una estructura cristalina centrada en las caras, color blanco azulado, y gran toxicidad para el hombre. El plomo se encuentra formando parte del mineral galena (PbS). El plomo forma aleaciones con muchos metales, y, en general, se emplea en esta forma en la mayor parte de sus aplicaciones. Todas las aleaciones formadas con estaño, cobre, arsénico, antimonio, bismuto, cloro, cloroformo, esteres, cadmio y sodio tienen importancia industrial.




PROPIEDADES














CARACTERÍSTICAS
| Símbolo químico | C | |
|---|---|---|
| Número atómico | 6 | |
| Grupo | 14 | |
| Periodo | 2 | |
| Aspecto | negro (grafito) o incoloro (diamante) | |
| Bloque | p | |
| Densidad | 2267 kg/m3 | |
| Masa atómica | 12.0107 u | |
| Configuración electrónica | [He]2s22p2 | |
| Electrones por capa | 2, 4 | |
| Estados de oxidación | 4, 2 | |
| Óxido | ácido débil | |
| Estructura cristalina | hexagonal | |
| Estado | sólido | |
| Punto de fusión | diamante: 3823 KGrafito: 3800 K K | |
| Punto de ebullición | grafito: 5100 K K | |
| Calor de fusión | grafito; sublima: 105 kJ/mol kJ/mol | |
| Electronegatividad | 2,55 | |
- El carbono presenta 5 formas alotrópicas: el grafito, el cual se presenta como hojas apiladas. El diamante es un cristal de estructura cúbica, forma tetraédrica con los átomos de carbonos ubicados en sus vértices.
- El Carbono es el elemento principal de los compuestos orgánicos. La rama de la química que lo estudia es la Química Orgánica.
- El Carbono está presente en varias formas alotrópicas:
- Grafito: Es una estructura formada por una red hexagonal en capas. Esta variedad del carbono es frágil, blanda, conductora de electricidad y sirve como lubricante. Es de color negro.
- Diamante: es una estructura densa cristalina en la que cada átomo de carbono está rodeado de otros cuatro. Esta variedad es extremadamente dura (dureza Mohs máxima), conductora de la electricidad. Es transparente.
- El Carbono forma parte del conocido Ciclo del Carbono, en el cual el carbono atmosférico del Dióxido de Carbono (CO2) se convierte en hidratos de carbono gracias al proceso de la fotosíntesis de las plantas
- El Carbono es sólido a temperatura ambiente.
- Se conocen millones de compuestos que contienen carbono.
- El isótopo de Carbono-14 se utiliza para datar la antigüedad de restos arqueológicos.
USOS
- El uso principal de carbono es en forma de hidrocarburos, principalmente gas metano y el petróleo crudo. El petróleo crudo se utiliza para producir gasolina y queroseno a través de su destilación.
- Los plásticos se fabrican a partir de polímeros sintéticos de carbono.
- El grafito, una forma de carbono, se combina con arcilla para hacer el principal componente de los lápices. El grafito se utiliza también como un electrodo en la electrólisis, ya que es inerte (no reacciona con otros productos químicos).
- El diamante es otra forma de carbono que se utilizan en joyería. Los diamantes industriales se utilizan para perforar, cortar o pulir metales y piedra.
- El carbono, en forma de coque, se utiliza para reducir el mineral de hierro en el metal de hierro.
- Cuando se combina con el silicio, tungsteno, boro y titanio, el carbono forma algunos de los compuestos más duros conocidos. Estos se utilizan como abrasivos en herramientas de corte y esmerilado.
- El hollín es un pigmento formado principalmente de carbono, que se adquiere mediante la combustión incompleta de diferentes materiales, como aceites, grasas, brea, hulla, maderas resinosas, plantas o gas. Este se agrega a la goma para optimizar sus propiedades mecánicas. Además se utiliza en la producción de electrodos para las baterías.
- SILICIO (Si)

Es un metaloide de numero atómico 14 de grupo A4. El silicio es el segundo elemento más abundante de la corteza terrestre (27,7% en peso) Se presenta en forma amorfa y cristalizada; el primero es un polvo parduzco, más activo que la variante cristalina, que se presenta en octaedros de color azul grisáceo y brillo metálico.
El silicio es el segundo elemento más abundante en la corteza terrestre. Presenta dos formas alotrópicas: una amorfa de color marrón, y una forma cristalina de color gris, brillo metálico y cristales cúbicos de diamantes.
El silicio natural contiene 92.2% del isótopo de masa número 28, 4.7% de silicio-29 y 3.1% de silicio-30. Además de estos isótopos naturales estables, se conocen varios isótopos radiactivos artificiales.
 |
| Silicio en estado natural |
El silicio elemental tiene las propiedades físicas de los metaloides, parecidas a las del germanio, situado debajo de él en el grupo IV de la tabla periódica.
El silicio se encuentra en muchas formas de dióxidos y en innumerables variaciones de los silicatos naturales. Para un análisis de las estructuras y composiciones de las clases representativas.
El silicio forma compuestos con 64 de los 96 elementos estables y probablemente forme siliciuros con otros 18 elementos. Además de los siliciuros metálicos, que se utilizan en grandes cantidades en metalurgia, forma compuestos importantes y de empleo frecuente con hidrógeno, carbono, los halógenos, nitrógeno, oxígeno y azufre.
CARACTERÍSTICAS
- Elemento químico de aspecto gris oscuro azulado con número atómico 14. Su símbolo es Si y pertenece al grupo de los metaloides y su estado habitual en la naturaleza es sólido. El silicio está situado en la posición 14 de la tabla periódica.
- En forma cristalina es muy duro y poco soluble y presenta un brillo metálico y color grisáceo. Aunque es un elemento relativamente inerte y resiste la acción de la mayoría de los ácidos, reacciona con los halógenos y álcalis diluidos. El silicio transmite más del 95% de las longitudes de onda de la radiación infrarroja.
- El Silicio se prepara en forma de polvo amarillo pardo o de cristales negros-grisáceos. Se obtiene calentando sílice, o dióxido de silicio (SiO2), El silicio cristalino tiene una dureza de 7, suficiente para rayar el vidrio, de dureza de 5 a 7. El silicio tiene un punto de fusión de 1.411 °C, un punto de ebullición de 2.355 °C y una densidad relativa de 2,33(g/ml). Su masa atómica es 28,086 u.
| Silicio | ||
|---|---|---|
| Símbolo químico | Si | |
| Número atómico | 14 | |
| Grupo | 14 | |
| Periodo | 3 | |
| Aspecto | gris oscuro azulado | |
| Bloque | p | |
| Densidad | 2330 kg/m3 | |
| Masa atómica | 28.0855 u | |
| Radio medio | 110 pm | |
| Radio atómico | 111 | |
| Radio covalente | 111 pm | |
| Estado | sólido |
|---|---|
| Punto de fusión | 1687 K |
| Punto de ebullición | 3173 K |
| Calor de fusión | 50.55 kJ/mol |
| Presión de vapor | 4,77 Pa a 1683 K |
| Electronegatividad | 1,9 |
PROPIEDADES
- Es el segundo elemento más abundante de la corteza terrestre (el primero es el oxígeno)
- En forma cristalina es muy duro (dureza Mohs =7) y con poca solubilidad presentando un brillo metálico de color gris.
- El Silicio es un elemento relativamente inerte
- El Silicio posee un punto de ebullición alto (2355ºC)
- Su densidad es relativamente ligera (2,3 g/ml)
- El silicio se rodea siempre de 4 átomos (índice de coordinación 4)
USOS
- El silicio es un semiconductor. Esto significa que el flujo eléctrico puede ser controlada mediante el uso de partes de silicio. Por lo tanto, el silicio es muy importante en la industria eléctrica. Componentes de silicio se utilizan en las computadoras, los transistores, células solares, pantallas LCD y otros dispositivos semiconductores.

- También se emplea ampliamente en aleaciones con el aluminio para elaborar piezas fundidas. Dichas se emplean habitualmente en la industria automovilística para producir piezas para autos.
- De los compuestos importantes del silicio está el óxido de silicio (IV) o dióxido de silicio (SiO2) o como se le conoce también sílice. Este compuesto se puede encontrar en la arena. La sílice se emplea para elaborar vidrio artificial, cerámicas, ladrillos, cemento, entre otros. El gel de sílice es un desecante, es decir que absorbe la humedad del lugar en que se halla.
 |
| Botellas de Vidrio |
- GERMANIO (Ge)

El germanio es un elemento químico de aspecto blanco grisáceo con número atómico 32. Su símbolo es Ge y pertenece al grupo de los metaloides y su estado habitual en la naturaleza es sólido. El germanio está situado en la posición 32 de la tabla periódica.
Es un metaloide de número atómico 32 y peso atómico 72,61 g/mol. El germanio es poco conocido en forma cotidiana. Solo se encuentra como traza en algunos minerales de plata y cinc, así como en algunos tipos de carbón y en la germanita. Es de color blanco grisáceo y forma una estructura cristalina cúbica y de diamante.
El germanio se encuentra muy distribuido en la corteza terrestre con una abundancia de 6.7 partes por millon (ppm). El germanio se halla como sulfuro o está asociado a los sulfuros minerales de otros elementos, en particular con los del cobre, zinc, plomo, estaño y antimonio.
El germanio tiene una apariencia metálica, pero exhibe las propiedades físicas y químicas de un metal sólo en condiciones especiales, dado que está localizado en la tabla periódica en donde ocurre la transición de metales a no metales. A temperatura ambiente hay poca indicación de flujo plástico y, en consecuencia, se comporta como un material quebradizo.
El germanio es divalente o tetravalente. Los compuestos divalentes (óxido, sulfuro y los halogenuros) se oxidan o reducen con facilidad. Los compuestos tetravalentes son más estables
CARACTERÍSTICAS
- Presenta la misma estructura cristalina que el diamante y resiste a los ácidos y álcalis.Es un metaloide sólido duro, cristalino, de color blanco grisáceo lustroso, quebradizo, que conserva el brillo a temperaturas ordinarias.
- Forma gran número de compuestos organometálicos y es un importante material semiconductor utilizado en transistores y foto detectores.
- A diferencia de la mayoría de semiconductores, el germanio tiene una pequeña banda prohibida (band gap) por lo que responde de forma eficaz a la radiación infrarroja y puede usarse en amplificadores de baja intensidad.
Nombre
|
Germanio
|
Número atómico
|
32
|
Valencia
|
4
|
| Estado de oxidación |
+4
|
Electronegatividad
|
1,8
|
Radio covalente (Å)
|
1,22
|
Radio iónico (Å)
|
0,53
|
Radio atómico (Å)
|
1,37
|
Configuración electrónica
|
[Ar]3d104s24p2
|
Primer potencial de ionización (eV)
| |
72,59
| |
Densidad (g/ml)
|
5,32
|
Punto de ebullición (ºC)
|
2830
|
Punto de fusión (ºC)
|
937,4
|
Clemens Winkler 1886
|
PROPIEDADES
USOS
- El Germanio es un metal blanco grisáceo y quebradizo.
- El estado del germanio en su forma natural es sólido.
- Posee la estractura cristalina igual que el diamante.
- El número atómico del germanio es 32.
- El símbolo químico del germanio es Ge.
- El punto de fusión del germanio es de 1211,4 grados Kelvin o de 939,25 grados celsius o grados centígrados.
- El punto de ebullición del germanio es de 3093 grados Kelvin o de 2820,85 grados celsius o grados centígrados.
- También se utiliza en determinadas aleaciones como endurecedor.
USOS
- Se usa generalmente, junto al silicio, en los circuitos integrados de alta velocidad para mejorar su rendimiento.

- También se utiliza en las lámparas fluorescentes y algunos didodos LED.


- El germanio al igual que el silicio es un semiconductor ampliamente utilizado en la industria electrónica.
 |
El germanio es usado en electrónica
debido a que es un semiconductor
|
- El óxido de germanio es empleado en el campo de la medicina como remedio en el tratamiento de algunos tipos de anemia. También se utiliza en la producción de vidrio óptico.
 |
Cápsulas de germanio orgánico
|
- El germanio se combina con el oxígeno para su uso en las lentes de las cámaras y la microscopía. También se utiliza para la fabricación del núcleo de cables de fibra óptica.
- Se puede utilizar en los paneles solares. De hecho, los robots exploradores de marte contienen germanio en sus células solares.

- ESTAÑO (Sn)

Tiene dos formas alotrópicas: forma β, de estructura cristalina tetragonal a temperatura ambiente; y forma α, de color gris que se encuentra a temperaturas inferiores a 13 ºC.El Estaño representa el 0,00023% en peso de la corteza. Raramente se encuentra nativo, siendo su principal mineral la casiterita (SnO2). También tiene importancia la estannita o pirita de estaño.
Es un metal plateado, maleable, que no se oxida fácilmente con el aire y es resistente a la corrosión. Se encuentra en muchas aleaciones y se usa para recubrir otros metales protegiéndolos de la corrosión. El estaño se obtiene principalmente a partir del mineral casiterita en donde se presenta como óxido. Existen dos formas alotrópicas del estaño: estaño blanco y estaño gris. El estaño reacciona tanto con ácidos fuertes como con bases fuertes, pero es relativamente resistente a soluciones casi neutras.
Se funde a baja temperatura; tiene gran fluidez cuando se funde y posee un punto de ebullición alto. es suave, flexible y resistente a la corrosión en muchos medios.
Es un metal plateado, maleable, que no se oxida fácilmente con el aire y es resistente a la corrosión. Se encuentra en muchas aleaciones y se usa para recubrir otros metales protegiéndolos de la corrosión. El estaño se obtiene principalmente a partir del mineral casiterita en donde se presenta como óxido. Existen dos formas alotrópicas del estaño: estaño blanco y estaño gris. El estaño reacciona tanto con ácidos fuertes como con bases fuertes, pero es relativamente resistente a soluciones casi neutras.
Se funde a baja temperatura; tiene gran fluidez cuando se funde y posee un punto de ebullición alto. es suave, flexible y resistente a la corrosión en muchos medios.
CARACTERÍSTICAS
- Es un metal, maleable, que no se oxida y es resistente a la corrosión.
- Se encuentra en muchas aleaciones y se usa para recubrir otros metales protegiéndolos de la corrosión.
- Una de sus características más llamativas es que bajo determinadas condiciones forma la peste del estaño.
- El estaño es extraído del mineral casiterita (SnO2).
Estaño
| |
Número atómico
|
50
|
Valencia
|
2,4
|
| Estado de oxidación |
+4
|
Electronegatividad
|
1,8
|
Radio covalente (Å)
|
1,41
|
Radio iónico (Å)
|
0,71
|
Radio atómico (Å)
|
1,62
|
Configuración electrónica
|
[Kr]4d105s25p2
|
Primer potencial de ionización (eV)
|
7,37
|
Masa atómica (g/mol)
|
118,69
|
Densidad (g/ml)
|
7,30
|
Punto de ebullición (ºC)
|
2270
|
Punto de fusión (ºC)
|
231,9
|
PROPIEDADES
- El estaño pertenece al grupo de elementos metálicos conocido como metales del bloque p que están situados junto a los metaloides o semimetales en la tabla periódica. Este tipo de elementos tienden a ser blandos y presentan puntos de fusión bajos, propiedades que también se pueden atribuir al estaño, dado que forma parte de este grupo de elementos.
- El estaño es un metal de color gris plateado con las propiedades de ser maleable y fácilmente oxidable.
 |
| Estaño casi en polvo |
- Según su forma alotrópica puede ser conductor o semiconductor.
- Es muy usado en diferentes aleaciones a las que confiere una protección contra la corrosión.
- El estado del estaño en su forma natural es sólido.
USOS
- Es usado abundantemente en aleaciones con otros elementos como por ejemplo, con el cobre para obtener bronce, con el plomo en la soldadura, con el titanio para la industria aeroespacial.
 |
| Recipiente de bronce (Cobre-Estaño) |
- Se utiliza mucho como protector de otros metales como el oro y el acero.

- En la Industria del vidrio es de uso indispensable para disminuir la fragilidad.

- A base de estaño es factible para producir tinte, dentífricos, pigmentos.
- En la Industria de la cerámica es muy común su uso.

- La combinación del Estaño con el cobre forma el bronce, con el plomo la aleación de soldadura y con el plomo y el antimonio el metal de imprenta. Con el titanio forma aleaciones para la industria aeroespacial.
- PLOMO (Pb)

Es flexible, inelástico, se funde con facilidad, se funde a 327.4ºC (621.3ºF) y hierve a 1725ºC (3164ºF).
Las valencias químicas normales son 2 y 4. Es relativamente resistente al ataque de los ácidos sulfúrico y clorhídrico. Pero se disuelve con lentitud en ácido nítrico. El plomo es anfótero, ya que forma sales de plomo de los ácidos, así como sales metálicas del ácido plúmbico.
Las valencias químicas normales son 2 y 4. Es relativamente resistente al ataque de los ácidos sulfúrico y clorhídrico. Pero se disuelve con lentitud en ácido nítrico. El plomo es anfótero, ya que forma sales de plomo de los ácidos, así como sales metálicas del ácido plúmbico.
 |
| Plomo en estado natural |
El plomo forma muchas sales, óxidos y compuestos organometálicos.
CARACTERÍSTICAS
USOS





PROPIEDADES
- El Plomo forma aleaciones con muchos metales como el calcio estaño y bronce, y, en general, se emplea en esta forma en la mayor parte de sus aplicaciones.
- Es un metal pesado y tóxico, y la intoxicación por plomo se denomina saturnismo o plumbosis.
Nombre
Plomo
Número atómico
82
Valencia
2,4
Estado de oxidación
+2
Electronegatividad
1,9
Radio covalente (Å)
1,47
Radio iónico (Å)
1,20
Radio atómico (Å)
1,75
Configuración electrónica
[Xe]4f145d106s26p2
Primer potencial de ionización (eV)
7,46
Masa atómica (g/mol)
207,19
Densidad (g/ml)
11,4
Punto de ebullición (ºC)
1725
Punto de fusión (ºC)
327,4
PROPIEDADES- El Plomo es un metal de color gris azulado plateado
- Este tipo de elementos tienden a ser blandos y presentan puntos de fusión bajos, propiedades que también se pueden atribuir al plomo, dado que forma parte de este grupo de elementos.
- El estado del plomo en su forma natural es sólido.
- El número atómico del plomo es 82.
- Es un metal pesado, flexible, inesástico
- Punto de fusión 327ºC
- Es utilizado para formar aleaciones
- Es un elemento tóxico
- El plomo forma muchas sales, óxidos y compuestos organometálicos.
- Forros para cables, ya sea la de teléfono, de televisión, de Internet o de electricidad, sigue siendo una forma de empleo adecuada. La ductilidad única del plomo lo hace particularmente apropiado para esta aplicación, porque puede estirarse para formar un forro continuo alrededor de los conductores internos.

- Por su excelente resistencia a la corrosión, el plomo encuentra un amplio uso en la construcción, en particular en la industria química.

- Pigmentos: que se utilizan con más frecuencia y en los que interviene este elemento son: El blanco de plomo (conocido también como albayalde) 2PbCO3.Pb(OH)2, Sulfato básico de plomo, El Tetróxido de plomo también conocido como minio, cromatos de plomo, El silicatoeno de plomo (más conocido en la industria de los aceros blandos) en los acabados del vidrio y de la cerámica

- Algunos de los compuestos de plomo se utilizan en la industria del vidrio como aditivo y pigmento, en la industria electrónica para tubos de televisión, en la industria del plástico como estabilizante, entre otros.
- FLEROVIO (FI)

Es un metal de número atómico 114 y un peso atómico de 287 g/mol. El flevorio es un elemento artificial, radiactivo y de vida muy corta. Sus propiedades son semejantes a las de los gases nobles, aunque es posible que sea un metal posterior a los metales de transición. El flerovio sólo puede obtenerse sintéticamente al bombardear otro elemento con partículas alfa.
CARACTERÍSTICAS
- Su nombre hace honor al físico ruso Gueorgui Fliórov
- En 1998 científicos rusos sintetizaron por primera vez el Flevorio
| Símbolo químico | Fl |
| Nº atómico (Z) | 114 |
| Masa atómica | 287 u |
| Grupo | 14 (IVA) - Carbonoideos |
| Periodo | Periodo 7 |
| Bloque | Bloque p |
| Config. electrónica | [Rn] 5f146d10 7s2 7p2 |
| Electrones nivel | 2, 8, 18, 32, 32, 18, 4 |
| Estados de oxidación | +2, +4 |

- El Flevorio es un elemento artificial
- Es un elemento radiactivo
- Su isótopo más estable tiene un periodo de semidesintegración es de segundos.
USOS
Debido a su escasez, al coste de su producción, a su corta vida media de sus isótopos y a su radiactividad, el flerovio no tiene aplicaciones más allá de la investigación científica.
GRUPO V A

El grupo VA está formado por los siguientes elementos:
- Nitrógeno (N)
- Fósforo (P)
- Arsénico (As)
- Antimonio (Sb)
- Bismuto (Bi)
- Moscovium (Mc)

Estos elementos componen el 0,33% en masa de la corteza terrestre y muy pocas veces se hallan nativos en la naturaleza y generalmente se encuentran en forma de compuestos ya sea óxidos, sulfuros, fosfatos, entre otros. Mediante la reducción de los óxidos con carbono o por calcinación y reducción de los sulfuros, se pueden obtener los mismos.
El único elemento metálico del grupo, el bismuto, está clasificado en la tabla periódica como “otros metales” junto a los metales de los grupos 13 y 14 . Poseen cinco electrones en su nivel energético más externo y presentan la siguiente configuración electrónica: ns2np3 (2 electrones s y 3 electrones p), exhibiendo los siguientes estados de oxidación: +3, +5 y -3. A medida que crece el número atómico, prevalecerá el estado de oxidación +3.
CARACTERÍSTICAS
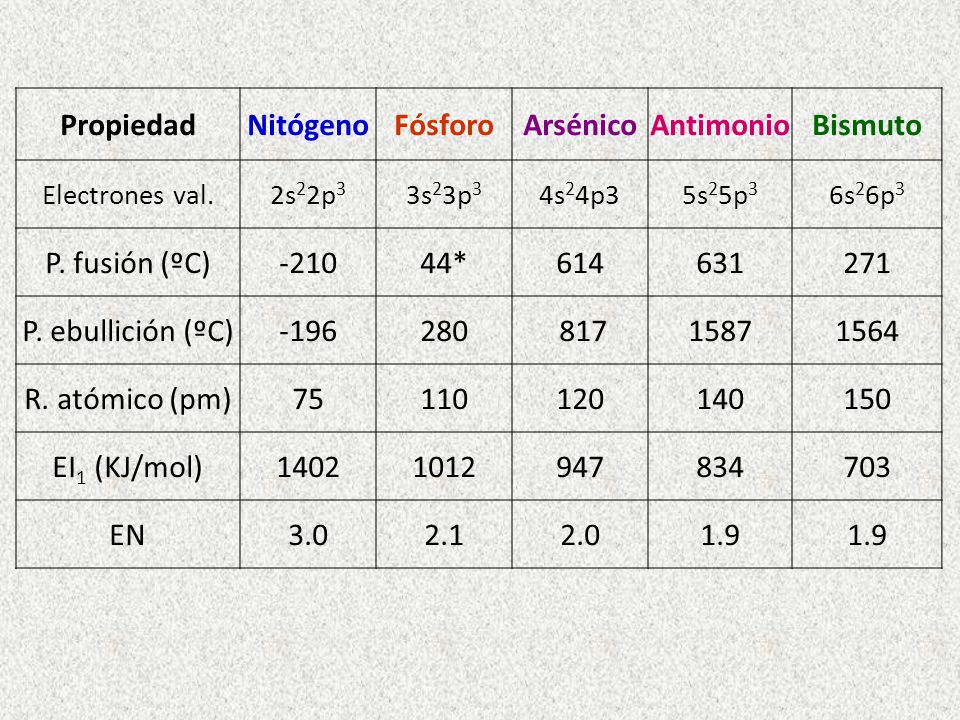
PROPIEDADES FÍSICAS

PROPIEDADES FÍSICAS
- Son muy reactivos a alta temperatura.
- Todos poseen al menos el estado de oxidación -3 debido a la facilidad que tienen de ganar o compartir 3 electrones para alcanzar la configuración del gas noble correspondiente
- También poseen el estado de oxidación + 5 de manera que tienen facilidad para perder 5 electrones y quedarse con la configuración de gas noble del periodo anterior
- En este grupo se acentúa la tendencia de las propiedades no metálicas.
- Tienen tendencia a la polimorfia, es decir, existen variedades alotrópicas con propiedades físicoquímicas muy diferentes.
PROPIEDADES QUÍMICAS
- El nitrógeno es un gas diatómico inerte que forma el 78,1 % en volumen del aire atmosférico. Además es un no metal incoloro.
- El fósforo es un no metal sólido de color blanco, pero puro es incoloro. En sus formas alotrópicas presentan diferentes coloraciones y propiedades.
- Los metaloides o semimetales de este grupo son el arsénico y antimonio.
- Son muy reactivos a altas temperaturas
- No reaccionan con el agua
- No reaccionan con ácidos no oxidantes
- Reaccionan con ácidos oxidantes a excepción del nitrógeno.
- Forman óxidos con número de oxidación +3 y +5, a excepción del nitrógeno que forma óxidos entre los rango +1 y +5.
- Los hidróxidos que forman disminuyen su acidez a medida que se desciende en el grupo, siendo básico el hidróxido de bismuto (III).
- El bismuto reacciona con el oxígeno y con halógenos, produciendo bismuta y bismutina entre otros compuestos.
Elementos que componen el grupo V A:
- NITROGENO (N)

El nitrógeno es un elemento químico de aspecto incoloro con número atómico 7. Su símbolo es N y pertenece al grupo de los no metales y su estado habitual en la naturaleza es gaseoso. Está situado en la posición 7 de la tabla periódica.
Es un gas diatómico inerte que forma el 78,1 % en volumen del aire atmosférico. Además es un no metal incoloro.
El nitrógeno molecular es el principal constituyente de la atmósfera ( 78% por volumen de aire seco).
Esta concentración es resultado del balance entre la fijación del nitrógeno atmosférico por acción bacteriana, eléctrica (relámpagos) y química (industrial) y su liberación a través de la descomposición de materias orgánicas por bacterias o por combustión.
En estado combinado, el nitrógeno se presenta en diversas formas. Es constituyente de todas las proteínas (vegetales y animales), así como también de muchos materiales orgánicos. Su principal fuente mineral es el nitrato de sodio.
En estado combinado, el nitrógeno se presenta en diversas formas. Es constituyente de todas las proteínas (vegetales y animales), así como también de muchos materiales orgánicos. Su principal fuente mineral es el nitrato de sodio.

CARACTERÍSTICAS
- El nitrógeno elemental tiene una reactividad baja hacia la mayor parte de las sustancias comunes, a temperaturas ordinarias.
- El nitrógeno, carbono e hidrógeno se combinan arriba de los 1800ºC (3270ºF) para formar cianuro de hidrógeno.
- Cuando el nitrógeno molecular se somete a la acción de un electrodo de descarga condensada o a una descarga de alta frecuencia se activa en forma parcial a un intermediario inestable y regresa al estado basal con emisión de un resplandor amarillo oro.
- Los compuestos que contienen una molécula de nitrógeno enlazada a un metal se llaman complejos de nitrógeno o complejos dinitrógeno
Nombre
|
Nitrógeno
|
Número atómico
|
7
|
Valencia
|
1,2,+3,-3,4,5
|
| Estado de oxidación |
- 3
|
Electronegatividad
|
3,0
|
Radio covalente (Å)
|
0,75
|
Radio iónico (Å)
|
1,71
|
Radio atómico (Å)
|
0,92
|
Configuración electrónica
|
1s22s22p3
|
Primer potencial de ionización (eV)
|
14,66
|
Masa atómica (g/mol)
|
14,0067
|
Densidad (g/ml)
|
0,81
|
Punto de ebullición (ºC)
|
-195,79 ºC
|
Punto de fusión (ºC)
|
-218,8
|
| Descubridor |
Rutherford en 1772
|
PROPIEDADES
- El nitrógeno, al igual que los demás elementos no metales, no tiene lustre.
- El nitrógeno tiene un total de 7 electrones cuya distribución es la siguiente: En la primera capa tiene 2 electrones y en la segunda tiene 5 electrones.
- Debido a su fragilidad, los no metales como el nitrógeno, no se pueden aplanar para formar láminas ni estirados para convertirse en hilos.
- El estado del nitrógeno en su forma natural es gaseoso.
- El nitrógeno es un elmento químico de aspecto incoloro y pertenece al grupo de los no metales.
- Es bastante inerte químicamente. Esto es debido a razones termodinámicas y cinéticas.
- Solo reacciona espontáneamente en la fijación del nitrógeno del aire por bacterias en procesos naturales que lo transforman en compuestos amoniacales o nitratos.
- El Nitrógeno es un gas incoloro que se encuentra en la atmósfera en forma de N2 con una proporción del 78%.
- También se encuenta en compuestos orgánicos como las proteínas.
COMPUESTOS
- Hidruros: actúa con estado de oxidación -1
- Amoníaco NH3
- Óxidos: actúa con estados de oxidación +1, +2, +3, +4, +5
- Monóxido de dinitrógeno N2O
- Óxido de nitrógeno NO
- Trióxido de dinitrógeno N2O3
- Dióxido de nitrógeno NO2
- Tetróxido de dinitrógeno N2O4
- Pentóxido de dinitrógeno N2O5
- Ácidos: actúa con estados de oxidación +1, +3, +5, +7
- Nitroxilo HNO
- Ácido nitroso HNO2
- Ácido nítrico HNO3
- Ácido peroxinítrico HNO4
- Sales: actúa con estados de oxidación +1, +3, +5
- Hiponitrito de Sodio NaNO
- Nitrito de Amonio NH4NO2
- Nitrito de Calcio Ca(NO3)2
USOS
- El gas nitrógeno se emplea usualmente en la parte superior de los explosivos líquidos para evitar que estallen. En menor escala se utiliza para inflar los neumáticos o llantas de los aviones y los automóviles.

- El nitrógeno también se emplea en la elaboración de bombillas como una opción más económica en comparación con el gas noble argón.

- es usado el nitrógeno líquido para enfriar los detectores de rayos X y las unidades centrales de procesamiento en las computadoras cuando están calientes.
- En el campo de la medicina y la biología, se utiliza también el nitrógeno líquido en una técnica llamada criopreservación. Esta técnica consiste en la congelación a muy bajas temperaturas (entre -80 ºC y -196 ºC) de células o tejidos para reducir las funciones vitales de una célula o un organismo y poder conservarlo en ambientes de vida suspendida por mucho tiempo.

- El nitrógeno líquido es usado para acelerar la cocción, para descartar los procesos bacterianos y para reducir que las pérdidas de propiedades organolépticas generen un deterioro.
 |
| El nitrógeno líquido se usa en la preparación de cócteles |
- FÓSFORO (P)

Es un elemento químico de aspecto incoloro, rojo o blanco plateado con número atómico 15. Su símbolo es P y pertenece al grupo de los no metales y su estado habitual en la naturaleza es sólido. El fósforo está situado en la posición 15 de la tabla periódica.
El fósforo forma la base de gran número de compuestos, de los cuales los más importantes son los fosfatos. En todas las formas de vida, los fosfatos desempeñan un papel esencial en los procesos de transferencia de energía, como el metabolismo, la fotosíntesis, la función nerviosa y la acción muscular. Los ácidos nucleicos, que entre otras cosas forman el material hereditario (los cromosomas), son fosfatos, así como cierto número de coenzimas. Los esqueletos de los animales están formados por fosfato de calcio.
Los fosfatos se basan en átomos de fósforo rodeados en una disposición tetraédrica por átomos de oxígeno, el miembro más pequeño de la familia es el anión simple PO3-4 (el ion ortofosfato). La familia de las cadenas de fosfato se basa en hileras alternadas de átomos de fósforo y oxígeno en que cada átomo de fósforo permanece en el centro de un tetraedro de cuatro átomos de oxígeno. Hay también una familia estrechamente relacionada de fosfatos cíclicos.


CARACTERÍSTICAS
- El fósforo se encuentra en el grupo 15 y periodo 3.
- El fósforo tiene una masa atómica de 30,9737620 u.
- La configuración electrónica del fósforo es [Ne]3s2 3p3.
- El fósforo tiene un total de 15 electrones cuya distribución es la siguiente: En la primera capa tiene 2 electrones, en la segunda tiene 8 electrones y en su tercera capa tiene 5 electrones.
- El fósforo está enlazado químicamente a cuatro átomos inmediatos. Hay gran número de compuestos en los que uno de los cuatro átomos está ausente y en su lugar hay un par de electrones no compartidos.
- NombreFósforoNúmero atómico15Valencia+3,-3,5,4
Estado de oxidación +5Electronegatividad2,1Radio covalente (Å)1,06Radio iónico (Å)0,34Radio atómico (Å)1,28Configuración electrónica[Ne]3s23p3Primer potencial de ionización (eV)11,00Masa atómica (g/mol)30,9738Densidad (g/ml)1,82Punto de ebullición (ºC)280Punto de fusión (ºC)44,2Descubridor Hennig Brandt en 1669
PROPIEDADES
- Es un elemento muy reactivo que se oxida espontáneamente al entrar en contacto con el oxígeno del aire
- Es un elemento esencial de los organismos vivos
- Emite luz por fosforescencia
- El fósforo, al igual que los demás elementos no metales, no tiene lustre.
- Debido a su fragilidad, los no metales como el fósforo, no se pueden aplanar para formar láminas ni estirados para convertirse en hilos.
- El estado del fósforo en su forma natural es sólido (diamagnético).
- El fósforo es un elmento químico de aspecto incoloro, rojo o blanco plateado y pertenece al grupo de los no metales.
COMPUESTOS
- Óxidos: actúa con los estados de oxidación +3 y +5
- Óxido de Fósforo (III) P2O3
- Óxido de Fósforo (V) P2O5
- Ácidos:
- Dioxofosfato (II) de hidrógeno HPO2
- Trioxofosfato (III) de hidrógeno H3PO3
- Trioxofosfato (V) de hidrógeno HPO3
- Tetraoxofosfato (V) de hidrógeno H3PO4
- Sales:
- Trioxofosfato (III) de trisodio Na3PO3
- Bis[tetraoxofosfato (V)] de tricalcio Ca3(PO4)2
- Minerales de Fósforo:
- Fosforita (Ca3(PO4)2)
USOS
- El fósforo es un componente importante del ADN y ARN y es un nutriente fundamental para las plantas, por lo cual se agrega a los fertilizantes para su elaboración.
 |
| El fósforo en forma de fosfatos esta presente en el ADN |
- El fósforo rojo se emplea en la fabricación de cerillos, fósforos de seguridad, cohetes.

- El tripolifosfato de sodio se emplea en algunos países como detergentes para ropa.

- El fósforo blanco se usa en bombas incendiarias, cortinas de humo (por ejemplo, bombas de humo) y en munición trazadora.

- ARSÉNICO (AS)

Es un elemento químico de aspecto gris metálico con número atómico 33. Su símbolo es As y pertenece al grupo de los metaloides y su estado habitual en la naturaleza es sólido. El arsénico está situado en la posición 33 de la tabla periódica. Se encuentra distribuido ampliamente en la naturaleza (cerca de 5 x 10-4% de la corteza terrestre). Es uno de los 22 elementos conocidos que se componen de un solo nucleido estable, 7533As; el peso atómico es de 74.922. Se conocen otros 17 nucleidos radiactivos de As.
Al arsénico se le encuentra natural como mineral de cobalto, aunque por lo general está en la superficie de las rocas combinado con azufre o metales como Mn, Fe, Co, Ni, Ag o Sn.
El principal mineral del arsénico es el FeAsS (arsenopirita, pilo); otros arseniuros metálicos son los minerales FeAs2 (löllingita), NiAs (nicolita), CoAsS (cobalto brillante), NiAsS (gersdorfita) y CoAs2 (esmaltita).
CARACTERISTICAS
- El arsénico elemental tiene pocos usos. Es uno de los pocos minerales disponibles con un 99.9999+ % de pureza.
- El arsénico es un elemento químico que se encuentra junto a otros minerales tales como el azufre y los metales.
- Es un metaloide que generalmente tiene un aspecto gris metálico.
- El arsénico es muy tóxico para la mayoría de los seres vivos y existen pocas especies de bacterias que sean capaces de utilizar los compuestos de arsénico sin que suponga un peligro para su vida.
| Arsénico | ||
|---|---|---|
| Símbolo químico | As | |
| Número atómico | 33 | |
| Grupo | 15 | |
| Periodo | 4 | |
| Aspecto | gris metálico | |
| Bloque | p | |
| Densidad | 5727 kg/m3 | |
| Masa atómica | 74.92160 u | |
| Radio medio | 115 pm | |
| Radio atómico | 114 | |
| Radio covalente | 119 pm | |
| Radio de van der Waals | 185 pm | |
| Configuración electrónica | [Ar]4s2 3d10 4p3 | |
| Electrones por capa | 2, 8, 18, 5 | |
| Estados de oxidación | +-3,5 | |
| Óxido | levemente ácido | |
| Estructura cristalina | romboédrica | |
| Estado | sólido | |
| Punto de fusión | 887 K | |
| Punto de ebullición | 1090 K | |
| Calor de fusión | 34.76 kJ/mol | |
| Electronegatividad | 2,18 | |
PROPIEDADES
- Al ser un metaloide, el Arsénico presenta propiedades intermedias entre los metales y no metales.
- El Arsénico se presenta principalmente en los sulfuros.
- Es extremadamente tóxico aunque en cantidades muy pequeñas es un elemento esencial para la vida.
- Se suele utilizar en semiconductores.
- Es buen conductor del calor aunque no así de la electricidad.
- En el estado sólido se ha empleado ampliamente en los materiales láser GaAs y como agente acelerador en la manufactura de varios aparatos.
- El estado del arsénico en su forma natural es sólido.
- El arsénico es un elemento químico de aspecto gris metálico y pertenece al grupo de los metaloides.
- El arsénico tiene un total de 33 electrones cuya distribución es la siguiente: En la primera capa tiene 2 electrones, en la segunda tiene 8 electrones, en su tercera capa tiene 18 electrones y en la cuarta, 5 electrones.
COMPUESTOS
- Óxidos:
- Trióxido de Arsénico As2O3
- Óxido de Arsénico (V) As2O5
- Ácidos:
- Trioxoarseniato (III) de Hidrógeno H3AsO3
- Tetraoxoarseniato (V) de Hidrógeno H3AsO4
- Sales:
- Dioxoarseniato (III) de Trisodio Na3AsO3
- Trioxoarseniato (V) de Tripotasio K3AsO4
USOS
- En su forma metálica es usado en aleaciones con cobre y plomo en la fabricación de baterías para automóviles, ya que le proporciona dureza y fortalecimiento a la misma.
- Se emplea en la industria electrónica en dispositivos semiconductores para elaborar láseres.

- Se ha utilizado como un conservante de madera debido a su toxicidad para los insectos, bacterias y hongos.

- El arsénico se añade a los alimentos de animales para prevenir enfermedades y favorecer su crecimiento.
- Se utiliza en numerosos pesticidas, herbicidas e insecticidas.

- El arsénico se utiliza en el tratamiento médico del cáncer, tales como la leucemia promielocítica aguda.
- ANTIMONIO (Sb)

El antimonio es un elemento químico de aspecto gris plateado con número atómico 51. Su símbolo es Sb y pertenece al grupo de los metaloides y su estado habitual en la naturaleza es sólido. El antimonio está situado en la posición 51 de la tabla periódica.
El antimonio no es un elemento abundante en la naturaleza; raras veces se encuentra en forma natural, a menudo como una mezcla isomorfa con arsénico: la allemonita. Su símbolo Sb se deriva de la palabra latina stibium.
El antimonio difiere de los metales normales por tener una conductividad eléctrica menor en estado sólido que en estado líquido (como su compañero de grupo el bismuto
El antimonio se obtiene calentando el sulfuro con hierro, o calentando el sulfuro y el sublimado de Sb4O6 obtenido se reduce con carbono; el antimonio de alta pureza se produce por refinado electrolítico.
El antimonio se obtiene calentando el sulfuro con hierro, o calentando el sulfuro y el sublimado de Sb4O6 obtenido se reduce con carbono; el antimonio de alta pureza se produce por refinado electrolítico.

CARACTERÍSTICAS
- El antimonio se presenta en dos formas: amarilla y gris. La forma amarilla es metaestable, y se compone de moléculas Sb4, se le encuentra en el vapor de antimonio y es la unidad estructural del antimonio amarillo; la forma gris es metálica, la cual cristaliza en capas formando una estructura romboédrica.
- El antimonio metálico es muy quebradizo, de color blanco-azuloso con un brillo metálico característico, de apariencia escamosa.
- Se encuentran en la naturaleza los antimoniuros metálicos NiSb (breithaupita), NiSbS (ulmanita) y Ag2Sb (dicrasita); existen numerosos tioantimoniatos como el Ag3SbS3 (pirargirita).
| Antimonio | ||
|---|---|---|
| Símbolo químico | Sb | |
| Número atómico | 51 | |
| Grupo | 15 | |
| Periodo | 5 | |
| Aspecto | gris plateado | |
| Bloque | p | |
| Densidad | 6697 kg/m3 | |
| Masa atómica | 121.760 u | |
| Radio medio | 145 pm | |
| Radio atómico | 133 | |
| Radio covalente | 138 pm | |
| Configuración electrónica | [Kr]4d105s25p3 | |
| Electrones por capa | 2, 8, 18, 18, 5 | |
| Estados de oxidación | +-3, 5 | |
| Óxido | acidez media | |
| Estructura cristalina | romboédrica | |
| Estado | sólido | |
| Punto de fusión | 903.78 K | |
| Punto de ebullición | 1860 K | |
| Calor de fusión | 19.87 kJ/mol | |
| Presión de vapor | 2,49 × 10-9Pa a 6304 K | |
| Electronegatividad | 2,05 | |
PROPIEDADES
- El Antimonio en condiciones normales es sólido, cristalino y fácil de quebrar
- Es mal conductor térmico y eléctrico
- Posee bajos puntos de ebullición
- El Antimonio es un elemento semimetálico cuyo color varía entre sus diferentes formas alotrópicas (blanco azulado, negro o amarillo)
- Es utilizado como semiconductor y también en aleaciones o mezclas para proporcionar resistencia contra el fuego
- El antimonio tiene un total de 51 electrones cuya distribución es la siguiente: En la primera capa tiene 2 electrones, en la segunda tiene 8 electrones, en su tercera capa tiene 18 electrones, en la cuarta, 18 electrones y en la quinta capa tiene 5 electrones.
- El punto de ebullición del antimonio es de 1860 grados Kelvin o de 1587,85 grados celsius o grados centígrados.
COMPUESTOS
Óxidos:
- Óxido de Antimonio (III) Sb2O3
- Pentóxido de Antimonio Sb2O5
USOS
- Es ampliamente utilizado en la electrónica como semiconductor en la fabricación de láseres, dispositivos de efecto Hall y detectores infrarrojos.

- Es usado en aleaciones con otros elementos como por ejemplo: se alea con el plomo para fabricar baterías y acumuladores para así proporcionar resistencia a la corrosión y dureza.
 |
- BISMUTO (Bi)

Es un elemento químico de aspecto rojo, blanco brillante con número atómico 83. Su símbolo es Bi y pertenece al grupo de los metales del bloque p y su estado habitual en la naturaleza es sólido. El bismuto está situado en la posición 83 de la tabla periódica. Es el elemento más metálico en este grupo, tanto en propiedades físicas como químicas.
El único isótopo estable es el de masa 209.
Se estima que la corteza terrestre contiene cerca de 0.00002% de bismuto. Existe en la naturaleza como metal libre y en minerales. El metal se combina en forma directa con los halógenos y con azufre, selenio y telurio, pero no con nitrógeno ni fósforo. No lo ataca el agua desgasificada a temperaturas comunes, pero se oxida lentamente al rojo por vapor de agua.

CARACTERÍSTICAS
- El bismuto es inerte al aire seco a temperatura ambiente, pero se oxida ligeramente cuando está húmedo.
- Forma rápidamente una película de óxido a temperaturas superiores a su punto de fusión, y se inflama al llegar al rojo formando el óxido amarillo, Bi2O3.
- El bismutato de sodio y el pentafluoruro de bismuto son quizá los compuestos más importantes de Bi(V). El primero es un agente oxidante poderoso y el último un agente fluorante útil para compuestos orgánicos.
|
PROPIEDADES
- El Bismuto es un metal
- Posee propiedades diamagnéticas
- Es mal conductor de la electricidad y del calor
- Se emplea en diversas aleaciones
- Es el elemento estable (no radiactivo) de mayor masa atómica
- Este tipo de elementos tienden a ser blandos y presentan puntos de fusión bajos, propiedades que también se pueden atribuir al bismuto, dado que forma parte de este grupo de elementos.
- Forma rápidamente una película de óxido a temperaturas superiores a su punto de fusión, y se inflama al llegar al rojo formando el óxido amarillo, Bi2O3.
- En casi todos los compuestos de bismuto está en forma trivalente.
COMPUESTOS
- Yoduro de Bismuto BiI3
- Oxicloruro de Bismuto BiOCl
USOS
- Es empleado abundantemente en la detección de incendios y dispositivos de supresión del sistema de seguridad.

- Son usadas en esmaltes cerámicos, plomadas de pesca, aparatos de procesamiento de alimentos, en plomería, soldaduras, entre otros.

- En el campo de la medicina es utilizado en la elaboración de varios medicamentos para el tratamiento de gripes, alergias y diarreas. El subsalicilato de bismuto es empleado para tratar la diarrea, acidez estomacal y malestar estomacal.

- Los cristales de bismuto pueden ser trabajados y se obtienen hermosos ornamentos a partir de él.

- MOSCOVIO (MC)

Es un elemento de la tabla periódica que acaba de ser reconocido en junio de 2016, con estructura atómica muy similar a los elementos que lo preceden, como el Nihonio (Nh – 113) y el Flevorio (Fv – 114).
CARACTERÍSTICAS
- Es un elemento metal sintético de color grisáceo con destellos de plateado y blanco.
Información General del Moscovio
| |
| Símbolo químico | Mc |
| Nº atómico (Z) | 115 |
| Masa atómica | 288 u |
| Grupo | 15 (VA) - Nitrogenoides |
| Periodo | Periodo 7 |
| Bloque | Bloque p |
| Config. electrónica | [Rn] 5f146d10 7s2 7p3 |
| Electrones nivel | 2, 8, 18, 32, 32, 18, 5 |
| Estados de oxidación | +1, +3 |
PROPIEDADES
- El Moscovio es un elemento artificial
- Es un elemento radioactivo
- Su periodo de semidesintegración es muy corto del orden de milisegundos
- Es presuntamente sólido al 298k, posee una masa atómica de 288u.
USOS
- Es empleado en menor medida en la investigación científica.

- Puede utilizarse para hacer Nihonio.
GRUPO VI A

Por otro lado, la palabra ‘anfígeno’ quiere decir capaz de formar compuestos ácidos o básicos. Un ejemplo sencillo de esto está en el hecho de que existen óxidos ácidos y básicos.
El Grupo de los Anfígenos está formado por los siguientes elementos:
- Oxígeno (O)
- Azufre (S)
- Selenio (Se)
- Telurio (Te)
- Polonio (Po)
- Livermorio (Lv)
El selenio y el telurio se hallan libres y combinados, no obstante con menos abundancia que los elementos anteriores.
En último lugar, tenemos al polonio, el cual es un elemento radiactivo que se halla difícilmente en la naturaleza, generalmente en forma de sales.
En cuanto a su configuración electrónica, poseen cinco electrones en su nivel energético más externo y presentan la siguiente configuración electrónica: ns2np4 (2 electrones s y 4 electrones p), exhibiendo los siguientes estados de oxidación: -2, +2, +4 y +6; los dos últimos se debe a la existencia de orbitales d a partir del azufre.
CARACTERÍSTICAS
En cuanto a su configuración electrónica, poseen cinco electrones en su nivel energético más externo y presentan la siguiente configuración electrónica: ns2np4 (2 electrones s y 4 electrones p), exhibiendo los siguientes estados de oxidación: -2, +2, +4 y +6; los dos últimos se debe a la existencia de orbitales d a partir del azufre.
CARACTERÍSTICAS
- Configuración electrónica: ns2p4
- Los estados de oxidacion mas usuales son: -2, +2, +4 y +6.
- El Oxigeno y el Azufre son no-metales, mientras que el carácter metálico aumenta del selenio al polonio.
- El oxigeno es un gas diatomico
- El Azufre es un solido amarillo formado por moléculas cíclicas de ocho átomos.
- El Polonio es un metal pesado.
- El carácter ácido de los oxoácidos disminuye según se desciende en el grupo, mientras que el de los calcogenuros de hidrógeno aumenta, siendo todos ellos débiles en disolución acuosa.
- Las combinaciones hidrogenadas de los elementos de este grupo, con excepción del agua, son gases tóxicos de olor desagradable.
PROPIEDADES FISICAS Y QUIMICA
- No reaccionan con el agua.
- No reaccionan con las bases a excepción del azufre.
- Reaccionan con el ácido nítrico concentrado, excepto el oxígeno.
- Forman óxidos, sulfuros, seleniuros y telururos con los metales, y dicha estabilidad se ve reducida desde el oxígeno al teluro.
- Con el oxígeno componen dióxidos que con agua originan oxoácidos. El carácter ácido de los oxoácidos disminuye a medida que se desciende en el grupo.
- Los calcogenuros de hidrógeno son todos débiles en disolución acuosa y su carácter ácido aumenta a medida que se desciende en el grupo.
- Las combinaciones hidrogenadas de estos elementos (excepto el agua) son gases tóxicos de olor desagradable.
- OXIGENO (O)

El oxígeno es un elemento químico de aspecto incoloro con número atómico 8. Su símbolo es O y pertenece al grupo de los no metales y su estado habitual en la naturaleza es gaseoso. El oxígeno está situado en la posición 8 de la tabla periódica.
El oxígeno se halla en la naturaleza siendo el elemento más abundante de la tierra con un 50,5% en masa de la corteza, encontrándose en el aire y combinado con hidrógeno para producir agua. También se encuentra formando óxidos, hidróxidos y algunas sales.
El oxígeno gaseoso no combinado suele existir en forma de moléculas diatómicas, O2, pero también existe en forma triatómica, O3, llamada ozono.
El oxígeno se separa del aire por licuefacción y destilación fraccionada.
La atmmósfera primitiva carecía de oxígeno. A partir de la aparición de la vida de seres unicelulares que absorbían CO2 y emitían oxígeno, empezó a surgir este elemento.
CARACTERÍSTICAS
- En condiciones normales el oxígeno es un gas incoloro, inodoro e insípido; se condensa en un líquido azul claro.
- El oxígeno es parte de un pequeño grupo de gases ligeramente paramagnéticos, y es el más paramagnético de este grupo.
- El oxígeno líquido es también ligeramente paramagnético.
- El oxígeno gaseoso es venenoso para las bacterias anaeróbicas que producen gangrena (muerte de tejidos orgánicos), por lo que se emplea para eliminarlos.
Nombre
|
Oxígeno
|
Número atómico
|
8
|
Valencia
|
2
|
| Estado de oxidación |
- 2
|
Electronegatividad
|
3,5
|
Radio covalente (Å)
|
0,73
|
Radio iónico (Å)
|
1,40
|
Radio atómico (Å)
|
-
|
Configuración electrónica
|
1s22s22p4
|
Primer potencial de ionización (eV)
|
13,70
|
Masa atómica (g/mol)
|
15,9994
|
Densidad (kg/m3)
|
1.429
|
Punto de ebullición (ºC)
|
-183
|
Punto de fusión (ºC)
|
-218,8
|
Descubridor
|
Joseph Priestly 1774
|
PROPIEDADES
- El estado del oxígeno en su forma natural es gaseoso (paramagnético).
- El Oxígeno es un elemento muy reactivo que forma compuestos, especialmente óxidos con gran parte de elementos.
- Es un agente oxidante con alta electronegatividad (solo superada por el flúor).
- Es el tercer elemento más abundante del universo
- Los átomos de oxígeno se unen en moléculas diatómicas (O2) el cual es un gas incoloro e inodoro y forma el 21% de la atmósfera terrestre.
- Es soluble en agua.
- Es un elemento indispensable para la vida
COMPUESTOS
El oxígeno puede formar óxidos tanto con metales como con no metales. También forma peróxidos. Algunos ejemplos son:
- Ozono O3
- Agua H2O
- Dióxido de Carbono CO2
- Dióxido de Silicio SiO2
- Alúmina Al2O3
- Óxido Férrico Fe2O3
- Carbonato Cálcico CaCO3
USOS
- Utilizado en medicina como terapia para las personas que tienen dificultad para respirar debido a alguna enfermedad como enfisema o neumonía.

- El oxígeno con un alto grado de pureza se emplea en los trajes espaciales para que los astronautas puedan respirar.

- Es usado en los tanques de buceo, no obstante, se suele combinar con aire normal. Los tanques de oxígeno son también utilizados frecuentemente en aviones y submarinos en caso de emergencias.

- Se utiliza en la producción de polímeros de poliéster y los anticongelantes. Los polímeros se utilizan para hacer plástico y telas.


- El oxigeno también es usado para cortar y soldar metales

- Es empleado asi mismo para el tratamiento del agua

- AZUFRE (S)

Es un no metal sólido de color amarillo limón que presenta un olor característico. Se presenta en varias formas alotrópicas, por ejemplo en estado sólido se pueden apreciar las variedades rómbica y monoclínica (anillos S8), azufre plástico (cadenas Sn). Por su parte, en estado líquido formando anillos S8 y cadenas de longitud variable y en fase gaseosa formando cicloazufre, que son cadenas Sn (n = 3-10), S2.
Elemento químico de aspecto amarillo limón con número atómico 16. Su símbolo es S y pertenece al grupo de los no metales y su estado habitual en la naturaleza es sólido.
El azufre está situado en la posición 16 de la tabla periódica.

Los isótopos estables conocidos y sus porcentajes aproximados de abundancia en el azufre natural son éstos: 32S (95.1%); 33S (0.74%); 34S (4.2%) y 36S (0.016%).
El azufre es un elemento activo que se combina directamente con la mayor parte de los elementos conocidos. Puede existir tanto en estados de oxidación positivos como negativos, y puede forma compuestos iónicos así como covalentes y covalentes coordinados.
CARACTERÍSTICAS
- El azufre rómbico, llamado también azufre y azufre alfa, es la modificación estable del elemento por debajo de los 95.5ºC (204ºF, el punto de transición), y la mayor parte de las otras formas se revierten a esta modificación si se las deja permanecer por debajo de esta temperatura. El azufre rómbico es de color amarillo limón, insoluble en agua, ligeramente soluble en alcohol etílico, éter dietílico y benceno, y es muy soluble en disulfuro de carbono. Su densidad es 2.07 g/cm3 (1.19 oz/in3) y su dureza es de 2.5 en la escala de Mohs. Su fórmula molecular es S8.
- El azufre monoclínico, llamado también azufre prismático y azufre beta, es la modificación estable del elemento por encima de la temperatura de transición y por debajo del punto de fusión.
- El azufre fundido se cristaliza en prismas en forma de agujas que son casi incoloras. Tiene una densidad de 1.96 g/cm3 (1.13 oz/in3) y un punto de fusión de 119.0ºC (246.7ºF). Su fórmula molecular también es S8.
- El azufre plástico, denominado también azufre gamma, se produce cuando el azufre fundido en el punto de ebullición normal o cerca de él es enfriado al estado sólido.
- El azufre líquido posee la propiedad notable de aumentar su viscosidad si sube la temperatura. Su color cambia a negro rojizo oscuro cuando su viscosidad aumenta, y el oscurecimiento del color y la viscosidad logran su máximo a 200ºC (392ºF). Por encima de esta temperatura, el color se aclara y la viscosidad disminuye.
- El azufre gaseoso presenta un color amarillo naranja. Cuando la temperatura aumenta, el color se torna rojo profundo y después se aclara, aproximadamente a 650º (202ºF), y adquiere un color amarillo paja.
Nombre
|
Azufre
|
Número atómico
|
16
|
Valencia
|
+2,2,4,6
|
| Estado de oxidación |
-2
|
Electronegatividad
|
2,5
|
Radio covalente (Å)
|
1,02
|
Radio iónico (Å)
|
1,84
|
Radio atómico (Å)
|
1,27
|
Configuración electrónica
|
[Ne]3s23p4
|
Primer potencial de ionización (eV)
|
10,36
|
Masa atómica (g/mol)
|
32,064
|
Densidad (g/ml)
|
2,07
|
Punto de ebullición (ºC)
|
444,6
|
Punto de fusión (ºC)
|
119,0
|
Descubridor
|
Los antiguos
|
- El azufre tiene un total de 16 electrones cuya distribución es la siguiente: En la primera capa tiene 2 electrones, en la segunda tiene 8 electrones y en su tercera capa tiene 6 electrones.
- Se presenta en la naturaleza en distintas combinaciones, normalmente como sulfatos (yeso, alabastro) y sulfuros (pirita...).
- Además se puede presentar en estado libre.
- Este azufre elemental se encuentra en capas del subsuelo no demasiado profundas.
- El Azufre posee distintas formas alotrópicas: rómbico, monoclínico y amorgo, este ultimo producido al fundirse.
- Cuando el Azufre se disuelve en Sulfuro de Carbono (CO2) se comprueba la existencia de moléculas de azufre constituidas por 8 átomos.
COMPUESTOS
- H2S → sulfuro de hidrógeno: gas tóxico de olor desagradable con carácter de ácido débil. Con hidrógeno el Azufre actúa con estado de oxidación -2.
- La sustitución del hidrógeno del H2S por elementos metálicos da lugar a los sulfuros
- Óxidos de Azufre → el Azufre forma óxidos actuando con estados de oxidación +4 o +6:
- Oxoácidos de Azufre → el Azufre forma oxoácidos actuando con estados de oxidación +4 o +6:
- H2SO3 Ácido sulfuroso
 |
| H2SO3 |
- H2SO4 Ácido sulfúrico
- Sales de Azufre → el Azufre forma sales actuando con estados de oxidación +4 o +6:
- Na2SO3 Sulfito de Sodio
- Na2SO4 Sulfato de Sodio
USOS
- Muchos agricultores que cultivan alimentos orgánicos emplean azufre como un pesticida y fungicida natural.

- El ácido sulfúrico Se emplea en la elaboración de fertilizantes, tratamiento de aguas residuales, baterías de plomo para vehículos, extracción de mineral, eliminación de óxido de hierro, producción de nylon y obtención de ácido clorhídrico.
 |
H2SO4, ácido sulfúrico
|
- El azufre se usa para vulcanizar caucho. El caucho vulcanizado se emplea para elaborar neumáticos para automóviles, mangueras, suelas de zapatos y discos de hockey sobre hielo.

- Otros compuestos de azufre (sulfitos) se utilizan para blanquear el papel y preservar la fruta.


- SELENIO (Se)

El selenio es un elemento químico de aspecto gris metálico con número atómico 34. Su símbolo es Se y pertenece al grupo de los no metales y su estado habitual en la naturaleza es sólido. El selenio está situado en la posición 34 de la tabla periódica.
La abundancia de este elemento, ampliamente distribuido en la corteza terrestre, se estima aproximadamente en 7 x 10-5% por peso, encontrándose en forma de seleniuros de elementos pesados y, en menor cantidad, como elemento libre en asociación con azufre elemental.
El selenio arde en el aire con una flama azul para dar dióxido de selenio, SeO2. El elemento también reacciona directamente con diversos metales y no metales, entre ellos el hidrógeno y los halógenos. Los ácidos no oxidantes, no reaccionan con el selenio; pero el ácido nítrico, el ácido sulfúrico concentrado y los hidróxidos alcalinos fuertes lo disuelven.


CARACTERÍSTICAS
- El selenio se puede encontrar en varias formas alotrópicas.
- El selenio amorfo existe en dos formas, la vítrea, negra, obtenida al enfriar rápidamente el selenio líquido, funde a 180 °C y tiene una densidad de 4,28 g/cm, la roja, coloidal, se obtiene en reacciones de reducción.
- El selenio gris cristalino de estructura hexagonal, la forma más común, funde a 220,5 °C y tiene una densidad de 4,81 g/cm y la forma roja, de estructura monoclínica, funde a 221 °C y tiene una densidad de 4,39 g/cm.
- Es insoluble en agua y alcohol, ligeramente soluble en disulfuro de carbono y soluble en éter.
Nombre
|
Selenio
|
Número atómico
|
34
|
Valencia
|
+2,-2,4,6
|
| Estado de oxidación |
-2
|
Electronegatividad
|
2,4
|
Radio covalente (Å)
|
1,16
|
Radio iónico (Å)
|
1,98
|
Radio atómico (Å)
|
1,40
|
Configuración electrónica
|
[Ar]3d104s24p4
|
Primer potencial de ionización (eV)
|
9,82
|
Masa atómica (g/mol)
|
78,96
|
Densidad (g/ml)
|
4,79
|
Punto de ebullición (ºC)
|
685
|
Punto de fusión (ºC)
|
217
|
Descubridor
|
Jons Berzelius 1817
|
PROPIEDADES
- El Selenio es indisoluble tanto en agua como en alcohol, ligeramente soluble en Disulfuro de Carbono (CS2) y soluble en éter
- Es conductor de electricidad, sobre todo al exponerlo a la luz
- Es un semiconductor tipo P
- A nivel biológico actúa como antioxidante y está presente en procesos hormonales
- El estado del selenio en su forma natural es sólido.
- El selenio es un elmento químico de aspecto gris metálico y pertenece al grupo de los no metales.
- El selenio tiene un total de 34 electrones cuya distribución es la siguiente: En la primera capa tiene 2 electrones, en la segunda tiene 8 electrones, en su tercera capa tiene 18 electrones y en la cuarta, 6 electrones.
COMPUESTOS
- Halogenuros de Hidrógeno: reaccionan con estado de oxidación -2
- Seleniuro de Hidrógeno H2Se
- Halogenuros Binarios: reaccionan con estado de oxidación -2
- Monoseleniuro de Disodio Na2Se
- Óxidos:
- Dióxido de Selenio SeO2
- Trióxido de Selenio SeO3
- Oxoácidos:
- Trioxoseleniato (IV) de Hidrógeno H2SeO3
- Tetraoxoseleniato (VI) de Hidrógeno H2SeO4
- Sales:
- Trioxoselenato (IV) de Dipotasio K2SeO3
- Tetraoxoselenato (VI) de Dipotasio K2SeO4
USOS
- El selenio gris conduce la electricidad por lo que se emplea en dispositivos fotoeléctricos, como las células solares, cámaras de rayos x, fotocopiadoras, medidores de luz, diodos LED de color azul y blanco.

- El selenio rojo o como seleniuro de sodio se emplea para proporcionar un color rojo carmesí al vidrio, barnices y esmaltes. También se puede usar para eliminar las tintas de color verde o amarillo ocasionados por otras impurezas durante el proceso de elaboración de vidrio.

- El compuesto sulfuro de selenio es un componente habitual en el champú anticaspa que elimina el hongo que origina la descamación del cuero cabelludo.

- El selenio se emplea también en exposímetros fotográficos.

- Se emplea también como aditivo metalúrgico que mejora la capacidad de ciertos aceros para ser maquinados.
- TELURIO (Te)

El telurio es un metaloide sólido de color gris plateado similar a la forma alotrópica del selenio gris, pero con un carácter más metálico. Es un elemento químico de aspecto gris plateado con número atómico 52. Su símbolo es Te y pertenece al grupo de los metaloides y su estado habitual en la naturaleza es sólido. El telurio está situado en la posición 52 de la tabla periódica.
El telurio constituye aproximadamente el 10-9 % de la roca ígnea que hay en la Tierra.
Se encuentra como elemento libre, asociado algunas veces con selenio, y también existe como telururo de silvanita (teluro gráfico), nagiagita (telurio negro), hessita, tetradimita, altaita, coloradoita y otros telururos de plata y oro, así como el óxido, telurio ocre.

CARACTERÍSTICAS
- El telurio se quema en aire despidiendo una flama azul y forma dióxido de telurio, TeO2.
- Reacciona con los halógenos, pero no con azufre o selenio, y forma, entre otros productos, tanto el anión telururo dinegativo (Te2-), que se asemeja al selenuro, como el catión tetrapositivo (Te4+), que se parece al platino (IV).
Nombre
|
Teluro
|
Número atómico
|
52
|
Valencia
|
+2,-2,4,6
|
| Estado de oxidación |
-2
|
Electronegatividad
|
2,1
|
Radio covalente (Å)
|
1,35
|
Radio iónico (Å)
|
2,21
|
Radio atómico (Å)
|
1,60
|
Configuración electrónica
|
[Kr]4d105s25p4
|
Primer potencial de ionización (eV)
|
9,07
|
Masa atómica (g/mol)
|
127,60
|
Densidad (g/ml)
|
6,24
|
Punto de ebullición (ºC)
|
988
|
Punto de fusión (ºC)
|
449,5
|
Descubridor
|
Franz Muller von Reichenstein en 1782
|
PROPIEDADES
- Es un metaloide sólido de color gris plateado similar a la forma alotrópica del selenio gris, pero con un carácter más metálico.
- El Telurio es insoluble en agua pero sí es soluble en Ácido Nítrico (HNO3)
- El estado del telurio en su forma natural es sólido (no-magnético)
- Es un elemento relativamente estable
- Se obteniene de la Calaverita.
- En cuanto a su conductividad eléctrica, este tipo de materiales al que pertenece el telurio, son semiconductores.
- El telurio tiene un total de 52 electrones cuya distribución es la siguiente: En la primera capa tiene 2 electrones, en la segunda tiene 8 electrones, en su tercera capa tiene 18 electrones, en la cuarta, 18 electrones y en la quinta capa tiene 6 electrones.
- Punto de fusión: 452ºC
- Punto de ebullición: 990ºC
COMPUESTOS
- Halogenuros de Hidrógeno: reaccionan con estado de oxidación -2
- Teluro de Hidrógeno H2Te
- Halogenuros Binarios: reaccionan con estado de oxidación -2
- Dicloruro de Teluro TeCl2
- Tetracloruro de Teluro TeCl4
- Monoteleluro de Dilitio Li2Te
- Óxidos:
- Dióxido de Teluro TeO2
- Trióxido de Teluro TeO3
- Oxoácidos:
- Trioxotelurato (IV) de Hidrógeno H2TeO3
- Tetraoxotelurato (VI) de Hidrógeno H2TeO4
- Sales:
- Trioxotelurato (IV) de Dipotasio K2TeO3
- Tetraoxotelurato (VI) de Dipotasio K2TeO4
USOS
- El telurio aleado con otros elementos es utilizado en la fabricación de discos compactos regrabables. La capa del CD-RW que contiene la información está constituida por una aleación cristalina de plata, indio, antimonio y telurio.

- También se alea con cobre y plomo para mejorar la tenacidad y dureza a la hora de elaborar rectificadores y dispositivos termoeléctricos.

- Al igual que el selenio, es utilizado para teñir el vidrio, en este caso de color azul.

- El telurio coloidal se usa como insecticida, germicida y fungicida.

- POLONIO (Po)

Es un elemento químico de aspecto plateado con número atómico 84. Su símbolo es Po y pertenece al grupo de los metaloides y su estado habitual en la naturaleza es sólido. El polonio está situado en la posición 84 de la tabla periódica. El descubrimiento del elemento químico Polonio fue realizado por Marie Curie en 1898.
El polonio es más metálico que su homólogo inferior, el telurio. Como metal, es químicamente parecido al telurio y forma los compuestos rojo brillante SPoO3 y SePoO3.
Es un metaloide altamente radiactivo, con una química equivalente al telurio y al bismuto. Este elemento muestra dos alótropos: el cúbico simple y el romboédrico, en los que cada átomo está directamente rodeado por seis vecinos a distancias iguales (d0=355pm). Ambos alótropos tienen carácter metálico.

CARACTERÍSTICAS
- El polonio se considera un elemento natural poco común. Aunque se encuentra en minerales de uranio, no es económico extraerlo ya que sólo hay alrededor de 100 microgramos de polonio en 1 tonelada (0,9 toneladas métricas) de mineral de uranio, según el Jefferson Lab.
- Es blando y sus propiedades físicas recuerdan las del talio, plomo y bismuto.
- El polonio está colocado entre la plata y el telurio en la serie electroquímica.
Nombre
Polonio
Número atómico
84
Valencia
4,6
Estado de oxidación
-
Electronegatividad
2,0
Radio covalente (Å)
-
Radio iónico (Å)
-
Radio atómico (Å)
1,76
Configuración electrónica
[Xe]4f145d106s26p4
Primer potencial de ionización (eV)
-
Masa atómica (g/mol)
210
Densidad (g/ml)
9,2
Punto de ebullición (ºC)
-
Punto de fusión (ºC)
254
Descubridor
Pierre y Marie Curie en 1898
PROPIEDADES
- El Polonio es un metaloide
- Es altamente radiactivo
- Es un elemento extremadamente tóxico
- Entre sus aplicaciones destaca su uso en la ingeniería nuclear.
- El estado del polonio en su forma natural es sólido (no magnético).
- La configuración electrónica del polonio es [Xe]4f14 5d10 6p4.
- El radio medio del polonio es de 190 pm
Forma compuestos de un rojo brillante como lo son:
- SPoO3
- SePoO3
- Los isótopos del polonio son una excelente fuente de radiación alfa pura. Aleado con berilio, es una fuente de neutrones.

- Se usa en dispositivos destinados a la ionización el aire para la eliminación de cargas electrostáticas en cepillos específicos para limpiar el polvo almacenado en películas fotográficas e impresiones.

- El isótopo Po-210 se emplea como fuente ligera de calor para proveer energía a las células termoeléctricas de ciertos satélites artificiales y sondas lunares.


- El Po-210 está presente en el humo de tabaco. Desde los años 60, las empresas de producción de tabaco se comprometieron a eliminar esta sustancia de sus productos pero no lo han logrado.

- LIVERMORIO (Lv)

Es un elemento químico de aspecto desconocido, probablemente metálico plateado blanco o gris con número atómico 116. Su símbolo es Uuh y pertenece al grupo de los metales del bloque p (presuntamente) y su estado habitual en la naturaleza es desconocido. El ununhexio está situado en la posición 116 de la tabla periódica. Es un elemento radiactivo y transactínido que no existe en la naturaleza, es decir que se produce en forma sintética.

CARACTERÍSTICAS
Información General del Livermorio
| |
| Símbolo químico | Lv |
| Nº atómico (Z) | 116 |
| Masa atómica | 293 u |
| Grupo | 16 (VIA) - Anfígenos |
| Periodo | Periodo 7 |
| Bloque | Bloque p |
| Config. electrónica | [Rn] 5f146d10 7s2 7p4 |
| Electrones nivel | 2, 8, 18, 32, 32, 18, 6 |
| Estados de oxidación | +2, +4 |
PROPIEDADES
- Es un elemento sumamente inestable con una vida media muy reducida.
- Actualmente se conocen 4 isótopos de livermorio, todos de descomposición con desintegración de tipo alfa. El más estable de los 4 es el isótopo 293-Lv, que tiene una vida media de apenas 53 milisegundos.
- Al igual que muchos elementos radiactivos y sintéticos, al producirse en pequeñas cantidades, no posee uso comercial. Por lo tanto, es empleado en la investigación científica.

GRUPO VII A

Los halógenos son fuertes oxidantes y reaccionan principalmente con los metales alcalinos (familia I A) que presentan la tendencia de ceder un electrón.
El grupo VII A está formado por:
- Flúor (F)
- Cloro (Cl)
- Bromo (Br)
- Yodo (I)
- Astato (At)
- Teneso (Ts)
Estos elementos se hallan en estado elemental formando moléculas diatómicas, aunque aún no está comprobado con el ástato), las cuales son químicamente activas y de fórmula X2. Posee la siguiente distribución electrónica: s2p5. Para llenar por completo su último nivel energético se necesita de un electrón más, por lo que poseen disposición a formar un ion mononegativo llamado haluro (X–).
CARACTERÍSTICAS
CARACTERÍSTICAS
- Tienen siete electrones de valencia en su capa externa.
- Al presentar una elevada electronegatividad de sus átomos tienen también la característica de tener una alta reactividad.
- Poseen la configuración electrónica s2p5.
- Todos los elementos del Grupo de los Halógenos poseen al menos la valencia -1
- Se pueden combinar con los metales y formar de esta manera halogenuros haluros.
- Reaccionan con mucha facilidad con los Hidrocarburos para dar lugar a los Halogenuros de Alguilo.
- Tienen energías de ionización muy altos.
- Al presentar una alta afinidad electrónica, tienen una fuerte tendencia a ganar el electrón que les falta para completar su configuración electrónica.
- Forman entre ellos mismos compuestos diatómicos.
- Los Halógenos son elementos fuertemente oxidantes, siendo el Flúor el de mayor carácter.
- Son no metálicos aunque sus propiedades pueden llegar a tener algún carácter metálico.
- Son tóxicos y tienen un olor característico.
PROPIEDADES FÍSICAS
- Son elementos no metálicos.
- El carácter metálico aumenta según se desciende en el grupo, es decir, a medida que aumenta el número atómico, por lo tanto, el yodo posee brillo metálico.
- Los halógenos se presentan en moléculas diatómicas y sus átomos se mantienen unidos por enlace covalente simple y la fuerza de dicho enlace disminuye al descender en el grupo.

- Los puntos de fusión y ebullición aumentan al descender en el grupo.
- Estos elementos, a temperatura ambiente, se hallan en los tres estados de la materia: en estado sólido el iodo y ástato, en estado líquido: bromo y en estado gaseoso el flúor y cloro.
- El flúor es un gas de color amarillo claro, levemente más pesado que el aire, corrosivo y de olor fuerte e irritante.
- El cloro es un gas amarillo verdoso de olor irritante y fuerte.
- El bromo es un líquido de color rojo oscuro, muchísimo más denso que el agua, que fácilmente se evapora originando un vapor rojizo venenoso.
- El yodo es un sólido cristalino de color negro y brillante, que sublima originando un vapor violeta bastante denso, venenoso y con un olor fuerte e irritante semejante al cloro.
- El ástato es muy raro, debido a que es producto intermedio de unas series de desintegración radiactiva.

PROPIEDADES QUIMICAS
- Los halógenos poseen 7 electrones en su capa más externa, lo que les proporciona un número de oxidación de -1, siendo considerablemente reactivos. Dicha reactividad disminuye según aumenta el número atómico.
- De igual manera, también exhiben los estados de oxidación +1, +3, +5, +7, con excepción del flúor, el cual es el elemento más reactivo y más electronegativo del grupo y de la tabla periódica.
- Se disuelven en agua y reaccionan parcialmente con ella, a excepción del flúor que la oxida.
- Reaccionan con el oxígeno produciendo óxidos inestables. Dicha reactividad disminuye a medida que se desciende en el grupo.
- Reaccionan con el hidrógeno para originar haluros de hidrógeno, los cuales se disuelven en agua, generando los ácidos hidrácidos. El ácido más fuerte es el yoduro de hidrógeno (HI).

Elementos que forman al grupo VII A:
- FLÚOR (F)

El flúor está situado en la posición 9 de la tabla periódica.
El flúor tiene un total de 9 electrones cuya distribución es la siguiente: En la primera capa tiene 2 electrones y en la segunda tiene 7 electrones.
El flúor es el elemento más electronegativo, y por un margen importante, el elemento no metálico más energético químicamente.
El flúor es un elemento muy tóxico y reactivo. Muchos de sus compuestos, en especial los inorgánicos, son también tóxicos y pueden causar quemaduras severas y profundas. Hay que tener cuidado para prevenir que líquidos o vapores entren en contacto con la piel y los ojos.

CARACTERÍSTICAS
- El flúor reacciona con violencia considerable con la mayor parte de los compuestos que contienen hidrógeno, como el agua, el amoniaco y todas las sustancias orgánicas, sean líquidos, sólidos o gases.
- La reacción del flúor con el agua es compleja y produce principalmente fluoruro de hidrógeno y oxígeno, así como cantidades menores de peróxido de hidrógeno, difluoruro de oxígeno y ozono.
- El flúor desplaza otros elementos no metálicos de sus compuestos, aun aquellos muy cercanos en cuanto a actividad química.
- El flúor diatómico, F2, en condiciones normales es un gas corrosivo de color amarillo casi blanco, fuertemente oxidante.
- En disolución acuosa, el flúor se presenta normalmente en forma de ion fluoruro, F-.
|
- Es un gas de color amarillo verdoso, de olor picante, pasa a estado líquido bajo presión ordinaria a 185º y tiene peso específico 1,26 con relación al aire.
- Las afinidades químicas de este cuerpo son extraordinariamente enérgicas.
- La reactividad del elemento es tan grande que reacciona con facilidad, a temperatura ambiente, con muchas otras sustancias elementales, entre ellas el azufre, el yodo, el fósforo, el bromo y la mayor parte de los metales.
- Dado que los productos de reacción con los no metales son líquidos o gases, las reacciones continúan hasta consumirlo por completo, con frecuencia con producción considerable de calor y luz.
- En las reacciones con los metales forma un fluoruro metálico protector que bloquea una reacción posterior a menos que la temperatura se eleve.
- Se combina a la temperatura ordinaria en frío, desprendiéndose Ácido fluorhídrico y ozono, siendo transformadas también las materias orgánicas, por la tendencia a formar dicho ácido.
- Ácido Fluorhídrico HF
- Fluoruro de Potasio KF
- Fluoruro de Calcio CaF2
- Tetrafluorometano CF4
- Hexafluoruro de Tungsteno WF6
- Es usado para elaborar televisores de pantallas plasma, pantallas planas y sistemas microelectromecánicos.

- Los anestésicos más generales son derivados de compuestos de flúor.
- El ácido fluorhídrico se utiliza para grabar vidrio, generalmente las bombillas.

- Compuestos de flúor como fluoruro de sodio, fluoruro estañoso y monofluorofosfato de sodio, son agregados a las cremas dentales para prevenir las caries.

- El flúor se usa para la elaboración de halones. Los halones son hidrocarburos halogenados utilizados como agentes extinguidores de incendios, como por ejemplo, el freón.

- Otro compuesto de flúor que es utilizado como aislante eléctrico es el politetrafluoruroetileno, un polímero mejor conocido como teflón. Este materia es utilizado comúnmente en utensilios de cocina, como sartenes y ollas, debido a su capacidad de rozamiento baja y facilidad de limpieza.
 |
| Sarten de teflón |
- El flúor se utiliza para obtener uranio puro a partir de hexafluoruro de uranio.

- CLORO (Cl)

Es el segundo en reactividad entre los halógenos, sólo después del flúor, y de aquí que se encuentre libre en la naturaleza sólo a las temperaturas elevadas de los gases volcánicos. Se estima que 0.045% de la corteza terrestre es cloro. Se combina con metales, no metales y materiales orgánicos para formar cientos de compuestos.
En condiciones normales y en estado puro forma dicloro: un gas tóxico amarillo-verdoso formado por moléculas diatómicas (Cl2) unas 2,5 veces más pesado que el Aire, de olor desagradable y venenoso.
Es un elemento abundante en la naturaleza y se trata de un elemento químico esencial para muchas formas de vida.
El cloro reemplaza al yodo y al bromo de sus sales. Interviene en reacciones de sustitución o de adición tanto con materiales orgánicos como inorgánicos. El cloro seco es algo inerte, pero húmedo se combina directamente con la mayor parte de los elementos.

CARACTERISTICAS
- El cloro se encuentra en la naturaleza combinado con otros elementos, principalmente en forma de cloruro de sodio, NaCl, y también otros minerales como la silvina, KCl, o la carnalita, KMgCl3•6H2O.
- Es el halógeno más abundante en el agua marina con una concentración de unos 18000 ppm.
- El cloro presente en la naturaleza se forma de los isótopos estables de masa 35 y 37; se han preparado artificialmente isótopos radiactivos.
- En la corteza terrestre está presente en menor cantidad, unos 130 ppm.
- Es prácticamente imposible encontrarlo sin combinar con otros elementos, debido a su alta reactividad.
- El cloro seco es algo inerte, pero húmedo se combina directamente con la mayor parte de los elementos.
|
PROPIEDADES
- En estado puro (Cl2) es un gas amarillo-verdoso de olor fuerte y tóxico
- El estado del cloro en su forma natural es gaseoso (no magnético).
- Es muy reactivo, reaccionando fácilmente con multitud de elementos y compuestos
- Es un elemento muy abundante en la naturaleza
- El punto de ebullición del cloro líquido (de color amarillo-oro), es -34.05°C a 760 mm de Hg (101.325 kilopascales)
- El cloro tiene una masa atómica de 35,453 u.
COMPUESTOS
- Halogenuros de hidrógeno: actúa con estado de oxidación -1
- Ácido Clorhídrico HCl
- Halogenuros binarios: actúa con estado de oxidación -1
- Cloruro Sódico NaCl
- Cloruro de Magnesio MgCl2
- Cloruro de Hierro (III) FeCl3
- Cloruro de Fósforo (V) PCl5
- Óxidos:
- Óxido de Cloro (I) Cl2O
- Óxido de Cloro (III) Cl2O3
- Heptaóxido de Dicloro Cl2O7
- Oxoácidos:
- Oxoclorato (I) de Hidrógeno HClO
- Dioxoclorato (III) de Hidrógeno HClO2
- Trioxoclorato (V) de Hidrógeno HClO3
- Tetraoxoclorato (VII) de Hidrógeno HClO4
- Sales:
- Oxoclorato (I) de Sodio NaClO
- Dioxoclorato (III) de Sodio NaClO2
- Trioxoclorato (V) de Sodio NaClO3
- Tetraoxoclorato (VII) de Sodio NaClO4
USOS



- El uso más comercial del cloro es en su forma de hipoclorito de sodio, cuya disolución en agua es llamada lejía.

- Este compuesto es utilizado abundantemente para eliminar las bacterias en las piscinas y en el agua potable.

- Otro uso de este elemento es en la obtención de bromo a partir de las salmueras, mediante la oxidación del bromuro con cloro:
2Br – + Cl2 → Br2 + 2Cl-
- Entre otras aplicaciones del cloroformo es en la extracción y purificación de la penicilina y otros antibióticos.

WEBGRAFÍA
https://www.youtube.com/watch?v=b4LFolL4QxM
https://www.lenntech.es/periodica/elementos/ge.htm#ixzz6FaJ5KkCs
https://www.google.com/search?q=YODO&tbm=isch&ved=2ahUKEwj8h_C_kePnAhXVElkKHUHHA54Q2cCegQIABAA&oq=YODO&gs_l=img.3..0i67l3j0j0i67j0l5.51368.52013..52299...0.0..0.180.670.0j4......0....1..gw-wizimg.......0i131.SrJZhhkEYlg&ei=8A5QXvzPOdWl5ALBjo_wCQ&bih=608&biw=1366












BUEN TRABAJO 5,0
ResponderEliminar