LOS LÍQUIDOS
ERIKA LORENA VALENCIA MARTINEZ
10 - 1
INSTITUCIÓN EDUCATIVA EXALUMNAS DE LA PRESENTACIÓN
2019


La viscosidad de un líquido crece al aumentar su masa molar y disminuye al crecer la temperatura. También está relacionada con la complejidad de las moléculas que constituyen el líquido: es baja en los gases inertes licuados y alta en los aceites pesados.


6) EVAPORACIÓN
Se trata del proceso en donde las moléculas situadas en la superficie de un líquido llegan a pasar a una fase gaseosa. Aquí la superficie donde el aire y el líquido entran en contacto, al igual que la temperatura llegan a favorecer el proceso.
Generalmente, la evaporación puede verse por la desaparición gradual del líquido cuando se expone a un volumen significativo de gas. Por término medio, las moléculas no tienen bastante energía para escaparse del líquido, porque de lo contrario el líquido se convertiría en vapor rápidamente. Cuando las moléculas chocan, se transfieren la energía de una a otra en grados variantes según el modo en que chocan.
Los líquidos que no parecen evaporarse visiblemente a una temperatura dada en un gas determinado (p. ej., el aceite de cocina a temperatura ambiente) poseen moléculas que no tienden a transferirse la energía de una a otra como para darle "la velocidad de escape" (la energía calórica) necesaria para convertirse en vapor. Sin embargo, estos líquidos se evaporan, pero el proceso es mucho más lento y considerablemente menos visible.
La evaporación también tiende a producirse más rápidamente con tasas de flujo más altas entre la fase gaseosa y líquida, y en líquidos con presión de vapor más alta.
7) CAPILARIDAD
El agua es una molécula "polar"; es decir, existe en ella una distribución irregular de la densidad electrónica.

Ejemplo
En el caso del agua salada las sustancias que se obtienen a través del ánodo y el cátodo son el cloro (Cl) y el hidrógeno (H) respectivamente ambos en estado gaseoso, quedando al final del proceso una disolución de hidróxido de sodio (NaOH).
AGUAS DURAS
Es aquella que contiene un alto nivel de minerales, concretamente de sales de magnesio y calcio. Este tipo de aguas suelen ser las subterráneas en suelos calcáreos, que elevan los niveles de cal y magnesio, entre otros.
Son aquellas que dificulta el desarrollo de espuma al estar en contacto con jabón, debido a que presenta una elevada cantidad de bicarbonatos y carbonatos de magnesio y de calcio. Para calcular la dureza del agua, se suelen sumar las concentraciones de magnesio y de calcio que están presentes en cada litro de agua.

 El agua natural es captada desde el lago y enviada a la estación de bombeo de la planta. Ahí comienza el proceso para obtenerla, en una instancia en la que interviene el amoníaco como una sustancia clave.
El agua natural es captada desde el lago y enviada a la estación de bombeo de la planta. Ahí comienza el proceso para obtenerla, en una instancia en la que interviene el amoníaco como una sustancia clave.
Según los manuales, “a diferencia del agua común, que tiene dos átomos de hidrógeno, y uno de oxígeno, el agua pesada está formada por dos átomos de deuterio y uno de oxígeno”. Una vez que concluye el proceso, se la envasa en tambores o containers de aluminio. Es incolora e insípida.
La principal aplicación tecnológica del agua pesada es como moderador y regulador en los reactores de uranio natural en los procesos de fisión nuclear, lo que permite que una central nuclear genere energía eléctrica



- ALIMENTOS

Aguas residuales. Producto del consumo urbano (aguas cloacales), de procesos industriales o de otros usos humanos cotidianos.
Basura y desechos sólidos. Como materiales de desecho, metales, plásticos, vidrios, objetos que caen de los barcos, etc.
Productos químicos y agrotóxicos. Los químicos empleados para la industria agrícola, para tratar los suelos o para otros usos puntuales, a menudo son lavados por la lluvia y se escurren hacia los mares o las aguas subterráneas.
Sedimentos y minerales. Como la ceniza volcánica, los sedimentos y partículas del suelo o de construcciones, como el polvillo, cal, etc.
Materiales radiactivos. Resultantes de plantas nucleares, son elementos sumamente tóxicos que se almacenan en envases de plomo y a menudo se arrojan al océano al no tener mejor sitio para disponerlos.
Desequilibrios biológicos. La presencia de ciertos químicos en el agua pueden causar la proliferación anormal de ciertos microbios o algas, lo cual desbalancea la cadena trófica y genera competencias anormales que, a la larga, ocasionan la muerte excesiva de ciertas especies que van a descomponerse añadiendo materia orgánica al agua.
Alteraciones químicas. Los cambios en la química del agua puede llegar a extremos letales, en los que la fauna y flora locales se extingan o migren hacia otras zonas, causando daños ecológicos severos.
Impacto climático. Los cambios de temperatura, pH y otras propiedades del agua consecuencia de sustancias añadidas o sólidos en suspensión inciden en el comportamiento de las masas del líquido, disminuyendo su evaporación y por lo tanto su precipitación y alterando el clima local.
Contaminación de tierra y aire. La contaminación hídrica no se queda sólo en el agua, sino que se esparce hacia la tierra y el aire, conforme al ciclo hídrico, en un efecto dominó de consecuencias impredecibles.
PROPIEDADES


La viscosidad de un líquido crece al aumentar su masa molar y disminuye al crecer la temperatura. También está relacionada con la complejidad de las moléculas que constituyen el líquido: es baja en los gases inertes licuados y alta en los aceites pesados.


6) EVAPORACIÓN
Se trata del proceso en donde las moléculas situadas en la superficie de un líquido llegan a pasar a una fase gaseosa. Aquí la superficie donde el aire y el líquido entran en contacto, al igual que la temperatura llegan a favorecer el proceso.
Generalmente, la evaporación puede verse por la desaparición gradual del líquido cuando se expone a un volumen significativo de gas. Por término medio, las moléculas no tienen bastante energía para escaparse del líquido, porque de lo contrario el líquido se convertiría en vapor rápidamente. Cuando las moléculas chocan, se transfieren la energía de una a otra en grados variantes según el modo en que chocan.
Los líquidos que no parecen evaporarse visiblemente a una temperatura dada en un gas determinado (p. ej., el aceite de cocina a temperatura ambiente) poseen moléculas que no tienden a transferirse la energía de una a otra como para darle "la velocidad de escape" (la energía calórica) necesaria para convertirse en vapor. Sin embargo, estos líquidos se evaporan, pero el proceso es mucho más lento y considerablemente menos visible.
La evaporación también tiende a producirse más rápidamente con tasas de flujo más altas entre la fase gaseosa y líquida, y en líquidos con presión de vapor más alta.
7) CAPILARIDAD

El agua es una molécula "polar"; es decir, existe en ella una distribución irregular de la densidad electrónica.


Ejemplo
En el caso del agua salada las sustancias que se obtienen a través del ánodo y el cátodo son el cloro (Cl) y el hidrógeno (H) respectivamente ambos en estado gaseoso, quedando al final del proceso una disolución de hidróxido de sodio (NaOH).
AGUAS DURAS
Es aquella que contiene un alto nivel de minerales, concretamente de sales de magnesio y calcio. Este tipo de aguas suelen ser las subterráneas en suelos calcáreos, que elevan los niveles de cal y magnesio, entre otros.
Son aquellas que dificulta el desarrollo de espuma al estar en contacto con jabón, debido a que presenta una elevada cantidad de bicarbonatos y carbonatos de magnesio y de calcio. Para calcular la dureza del agua, se suelen sumar las concentraciones de magnesio y de calcio que están presentes en cada litro de agua.

 El agua natural es captada desde el lago y enviada a la estación de bombeo de la planta. Ahí comienza el proceso para obtenerla, en una instancia en la que interviene el amoníaco como una sustancia clave.
El agua natural es captada desde el lago y enviada a la estación de bombeo de la planta. Ahí comienza el proceso para obtenerla, en una instancia en la que interviene el amoníaco como una sustancia clave.
Según los manuales, “a diferencia del agua común, que tiene dos átomos de hidrógeno, y uno de oxígeno, el agua pesada está formada por dos átomos de deuterio y uno de oxígeno”. Una vez que concluye el proceso, se la envasa en tambores o containers de aluminio. Es incolora e insípida.
La principal aplicación tecnológica del agua pesada es como moderador y regulador en los reactores de uranio natural en los procesos de fisión nuclear, lo que permite que una central nuclear genere energía eléctrica




- ALIMENTOS

Aguas residuales. Producto del consumo urbano (aguas cloacales), de procesos industriales o de otros usos humanos cotidianos.
Basura y desechos sólidos. Como materiales de desecho, metales, plásticos, vidrios, objetos que caen de los barcos, etc.
Productos químicos y agrotóxicos. Los químicos empleados para la industria agrícola, para tratar los suelos o para otros usos puntuales, a menudo son lavados por la lluvia y se escurren hacia los mares o las aguas subterráneas.
Sedimentos y minerales. Como la ceniza volcánica, los sedimentos y partículas del suelo o de construcciones, como el polvillo, cal, etc.
Materiales radiactivos. Resultantes de plantas nucleares, son elementos sumamente tóxicos que se almacenan en envases de plomo y a menudo se arrojan al océano al no tener mejor sitio para disponerlos.
Desequilibrios biológicos. La presencia de ciertos químicos en el agua pueden causar la proliferación anormal de ciertos microbios o algas, lo cual desbalancea la cadena trófica y genera competencias anormales que, a la larga, ocasionan la muerte excesiva de ciertas especies que van a descomponerse añadiendo materia orgánica al agua.
Alteraciones químicas. Los cambios en la química del agua puede llegar a extremos letales, en los que la fauna y flora locales se extingan o migren hacia otras zonas, causando daños ecológicos severos.
Impacto climático. Los cambios de temperatura, pH y otras propiedades del agua consecuencia de sustancias añadidas o sólidos en suspensión inciden en el comportamiento de las masas del líquido, disminuyendo su evaporación y por lo tanto su precipitación y alterando el clima local.
Contaminación de tierra y aire. La contaminación hídrica no se queda sólo en el agua, sino que se esparce hacia la tierra y el aire, conforme al ciclo hídrico, en un efecto dominó de consecuencias impredecibles.
INTRODUCCIÓN
El líquido es un estado de la materia, por el cual sus moléculas se adaptan al receptáculo que las contiene, están cerca unas de otras, con algunos huecos que permiten su fluidez, ejerciendo entre ellas mutuamente fuerzas de cohesión, y tienen tendencia a nivelarse. Se hallan en estado líquido el agua, el vino, el vinagre, etcétera. Los líquidos junto a los gases, conforman los fluidos. Es un estado intermedio de agregación entre los gases y los sólidos.
El agua es el elemento más importante para la vida. Es de vital importancia para el ser humano, así como para el resto de animales y seres vivos que nos acompañan en el planeta Tierra. Resulta curioso que el 70 por ciento de la Tierra sea agua y que el 70 por ciento de nuestro cuerpo también sea agua.
OBJETIVOS
- Identificar las propiedades quimicas y biologicas de los liquidos.
- Describir la estructura molecular del agua y sus caracteristicas.
- Comprender el proceso del peroxido de hidrogeno.
- Reconocer y analizar la contaminación que se produce en el agua y tomar medidas.
MARCO TEÓRICO
LOS LÍQUIDOS
Un líquido es un fluido que presenta un volumen constante en un rango amplio de presión. Es el único estado de agregación de la materia que presenta un volumen definido, pero nunca de manera fija.
PROPIEDADES
PROPIEDADES
1) LA TENSIÓN SUPERFICIAL
La tensión superficial se debe a que las fuerzas que afectan a cada molécula son diferentes en el interior del líquido y en la superficie. Así, en el seno de un líquido cada molécula está sometida a fuerzas de atracción que en promedio se anulan. Esto permite que la molécula tenga una energía bastante baja. Sin embargo, en la superficie hay una fuerza neta hacia el interior del líquido. Rigurosamente, si en el exterior del líquido se tiene un gas, existirá una mínima fuerza atractiva hacia el exterior, aunque en la realidad esta fuerza es despreciable debido a la gran diferencia de densidades entre el líquido y gas.

Otra manera de verlo es que una molécula en contacto con su vecina está en un estado menor de energía que si no estuviera en contacto con dicha vecina. Las moléculas interiores tienen todas las moléculas vecinas que podrían tener, pero las partículas del contorno tienen menos partículas vecinas que las interiores y por eso tienen un estado más alto de energía. Para el líquido, el disminuir su estado energético es minimizar el número de partículas en su superficie.
Energéticamente, las moléculas situadas en la superficie tiene una mayor energía promedio que las situadas en el interior, por lo tanto la tendencia del sistema será disminuir la energía total, y ello se logra disminuyendo el número de moléculas situadas en la superficie, de ahí la reducción de área hasta el mínimo posible.
2) FLUIDEZ
Esta propiedad hace que los líquidos puedan pasar fácilmente a través de un agujero sin importar su tamaño, siempre y cuando este agujero se encuentre a un inferior o el mismo nivel del recipiente en donde se está almacenado el líquido.
Esta propiedad hace que los líquidos puedan pasar fácilmente a través de un agujero sin importar su tamaño, siempre y cuando este agujero se encuentre a un inferior o el mismo nivel del recipiente en donde se está almacenado el líquido.
Esta propiedad indica la capacidad de deformación de un líquido la cual es muy amplia sin requerir de una tensión mecánica.
Tambièn es una característica de los líquidos o gases que les confiere la habilidad de poder pasar por cualquier orificio o agujero por más pequeño que sea, siempre que esté a un mismo nivel del recipiente en el que se encuentren el líquido a diferencia del restante estado de agregación conocido como sólido.
.
Tambièn es una característica de los líquidos o gases que les confiere la habilidad de poder pasar por cualquier orificio o agujero por más pequeño que sea, siempre que esté a un mismo nivel del recipiente en el que se encuentren el líquido a diferencia del restante estado de agregación conocido como sólido.
.
La fluidez se debe a que un fluido puede adquirir una deformación arbitrariamente grande sin necesidad de ejercer una tensión mecánica los líquidos la tensión mecánica o presión en el seno del fluido depende esencialmente de la velocidad de la deformación no de la deformación en sí misma a diferencia de los sólidos que tienen memoria de forma y experimentan tensiones tanto más grandes cuanto más se alejan de la forma original, es decir, en un sólido la tensión está relacionada primordialmente con el grado de deformación.

La viscosidad de un líquido crece al aumentar su masa molar y disminuye al crecer la temperatura. También está relacionada con la complejidad de las moléculas que constituyen el líquido: es baja en los gases inertes licuados y alta en los aceites pesados.
Es una propiedad característica de todo fluido (líquidos o gases).
La viscosidad es una medida de la resistencia al desplazamiento de un fluido cuando existe una diferencia de presión.
Cuando un líquido o un gas fluyen se supone la existencia de una capa estacionaria, de líquido o gas, adherida sobre la superficie del material a través del cual se presenta el flujo. La segunda capa roza con la adherida superficialmente y esta segunda con una tercera y así sucesivamente. Este roce entre las capas sucesivas es el responsable de la oposición al flujo, o sea, el responsable de la viscosidad.
La viscosidad se mide en poises, siendo un poise la viscosidad de un líquido en el que para deslizar una capa de un centímetro cuadrado de área a la velocidad de 1 cm/s respecto a otra estacionaria situado a 1 cm de distancia fuese necesaria la fuerza de una dina.
La viscosidad suele decrecer en los líquidos al aumentar la temperatura, aunque algunos pocos líquidos presentan un aumento de viscosidad cuando se calientan. Para los gases la viscosidad aumenta al aumentar la temperatura.
La viscosidad de un líquido se determina por medio de un viscosímetro entre los cuales el más utilizado es el de Ostwald. Este se utiliza para determinar viscosidad relativa, es decir, que conociendo la viscosidad de un líquido patrón, generalmente agua, se obtiene la viscosidad del líquido problema a partir de la ecuación:


4) PRESIÓN DE VAPOR
La presión de vapor es una propiedad de todo líquido que dependerá directamente de la temperatura, de igual forma sucede con el calor de vaporización, el punto de solidificación y el punto de ebullición.
Un líquido puede ser sobrecalentado indicando así que ha pasado su punto de ebullición; o puede ser superenfriado, indicando que está por debajo de su punto de congelación.
Cuando la velocidad de las moléculas que abandonan la superficie del líquido (evaporación) es igual a la velocidad de las moléculas que regresan al líquido (condensación), se establece un equilibrio dinámico. En este momento ya no se modifica la cantidad de moléculas en el estado vapor.
El vapor ejerce entonces una presión constante conocida como presión de vapor del líquido.
La presión de vapor de un líquido depende de la temperatura: a mayor T,mayor es la Pvapor.
5) PUNTO DE EBULLICIÓN
Refiere a la temperatura donde la presión de vapor del líquido es la misma que la presión atmosférica, o sea, que la presión que se se ejerce sobre dicho líquido. Un líquido llega a presentar diferentes puntos de ebullición según las condición de presión en la cual se encuentre.
El punto normal de ebullición es de 760 mm de Hg, lo cual equivale a 1 atm.
Calor de vaporización, es una medida de la intensidad de las fuerzas intermoleculares que se ejercen en un líquido. Se define como la cantidad de calor necesario para pasar una cantidad de una sustancia, del estado líquido al estado gaseoso, a la temperatura de ebullición.

6) EVAPORACIÓN
Generalmente, la evaporación puede verse por la desaparición gradual del líquido cuando se expone a un volumen significativo de gas. Por término medio, las moléculas no tienen bastante energía para escaparse del líquido, porque de lo contrario el líquido se convertiría en vapor rápidamente. Cuando las moléculas chocan, se transfieren la energía de una a otra en grados variantes según el modo en que chocan.
Los líquidos que no parecen evaporarse visiblemente a una temperatura dada en un gas determinado (p. ej., el aceite de cocina a temperatura ambiente) poseen moléculas que no tienden a transferirse la energía de una a otra como para darle "la velocidad de escape" (la energía calórica) necesaria para convertirse en vapor. Sin embargo, estos líquidos se evaporan, pero el proceso es mucho más lento y considerablemente menos visible.
La evaporación también tiende a producirse más rápidamente con tasas de flujo más altas entre la fase gaseosa y líquida, y en líquidos con presión de vapor más alta.
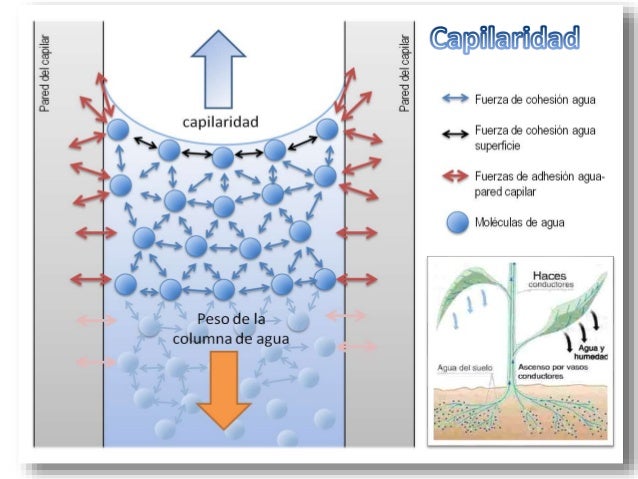
7) CAPILARIDAD
La capilaridad es una propiedad de los líquidos que depende de su tensión superficial. Las fuerzas entre las moléculasde un líquido se llaman fuerzas de cohesión y, aquellas entre las moléculas del líquido y las de la superficie de un sólido, se denominan fuerzas de adhesión, lo que les permite ascender por un tubo capilar (de diámetro muy pequeño).

Cuando un líquido sube por un tubo capilar, es debido a que la fuerza de cohesión es menor a la adhesión del líquido con el material del tubo. El líquido sigue subiendo hasta que la tensión superficial es equilibrada por el peso del líquido que llena el tubo. Éste es el caso del agua y, ésta propiedad es la que regula parcialmente su ascenso dentro de las plantas, sin gastar energía para vencer la gravedad.
Sin embargo, cuando la cohesión entre las moléculas de un líquido es más potente que la adhesión al capilar (como el caso del mercurio), la tensión superficial hace que el líquido descienda a un nivel inferior y su superficie es convexa.
La masa líquida es inversamente proporcional al cuadrado del diámetro del tubo, por lo que un tubo angosto succionará el líquido en una longitud mayor que un tubo ancho
La masa líquida es inversamente proporcional al cuadrado del diámetro del tubo, por lo que un tubo angosto succionará el líquido en una longitud mayor que un tubo ancho
AGUA
ESTRUCTURA MOLECULAR
El agua está compuesta por un átomo de oxígeno y dos de hidrógeno. Cada átomo de hidrógeno se encuentra unido covalentemente al oxígeno por medio de un par de electrones de enlace. El oxígeno tiene además dos pares de electrones no enlazantes. De esta manera existen cuatro pares de electrones rodeando al átomo de oxígeno: dos pares formando parte de los enlaces covalentes con los átomos de hidrógeno y dos pares no compartidos en el lado opuesto. El oxígeno es un átomo electronegativo o "amante" de los electrones, a diferencia del hidrógeno.
El agua es una molécula "polar"; es decir, existe en ella una distribución irregular de la densidad electrónica.

PROPIEDADES QUÍMICAS
- Elevada fuerza de cohesión entre sus moléculas: debido a los puentes de hidrógeno que se establecen las moléculas de agua permanecen unidas entre sí de forma más intensa que en otros compuestos similares.
- El agua es un líquido prácticamente incompresible: no es fácil reducir su volumen mediante presión, pues las moléculas de agua están enlazadas entre sí manteniendo unas distancias intermoleculares más o menos fijas. Por ello muchos organismos usan agua para fabricar sus esqueletos hidrostáticos, como los anélidos y celentéreos.
- Elevada tensión superficial: su superficie opone gran resistencia a romperse, lo que permite que muchos organismos puedan “andar” sobre el agua y vivan asociados a esa película superficial.
- Capilaridad: ascenso de la columna de agua a través de tubos de diámetro capilar, fenómeno que depende de la capacidad de adhesión de las moléculas de agua a las paredes de los conductos capilares y de la cohesión de las moléculas de agua entre si. Las plantas utilizan esta propiedad para la ascensión de la sabia bruta por el xilema.
- Elevado calor específico: Hace falta mucha energía para elevar su temperatura. esto convierte al agua en un buen aislante térmico.
- Elevado calor de vaporización: debido a que para pasar al estado sólido parte de la energía suministrada se emplea en romper los enlaces de puentes de hidrógeno.
- Mayor densidad en estado liquido que en estado sólido: el hielo flota en el agua.
- Elevada constante dieléctrica. Al ser un dipolo el agua se convierte en el gran disolvente universal: compuestos iónicos y polares se disuelven fácilmente en agua.
- Bajo grado de ionización: sólo una de cada 551.000.000 moléculas de agua se encuentra disociada en forma iónica. La concentración de iones hidroxilo (OH-1) y de iones de hidrógeno (protones) H+ es la misma 10-7 molar. El agua es desde el punto de vista del pH, neutra.
Hay que tener lo siguente
PROPIEDADES BIOLÓGICAS
• Es el disolvente de numerosas sustancias.
• Es el medio donde se realizan las reacciones metabólicas.
• Posee una función activa en la estructura celular.
• Tiene función mecánica amortiguadora en el interior del organismo.
• Participa como “vehículo” en el transporte de sustancias en el interior del organismo y en su intercambio con el medio ambiente.
• Contribuye a la regulación de la temperatura corporal.
• Es el hábitat de muchas especies.
ELECTROLICIS DEL H2O
• Es el disolvente de numerosas sustancias.
• Es el medio donde se realizan las reacciones metabólicas.
• Posee una función activa en la estructura celular.
• Tiene función mecánica amortiguadora en el interior del organismo.
• Participa como “vehículo” en el transporte de sustancias en el interior del organismo y en su intercambio con el medio ambiente.
• Contribuye a la regulación de la temperatura corporal.
• Es el hábitat de muchas especies.
ELECTROLICIS DEL H2O
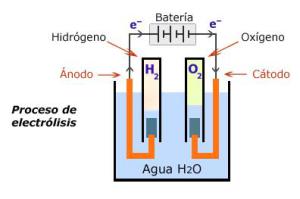
La electrólisis es un proceso electroquímico de oxidación-reducción que ocurre al pasar la energía eléctrica a través de un electrólito fundido o disolución acuosa.
En el caso del agua para que este proceso ocurra se deben cumplir las siguientes condiciones:
- El agua no puede estar en estado puro, o sea debe tener pequeñas concentraciones de sales u otros minerales.
- Se debe usar corriente directa en este proceso.

La electrólisis del agua permite que se obtenga los elementos químicos que la componen de forma pura o sea el hidrógeno(H) a través del cátodo y el oxígeno(O) a través del ánodo, ambos en estado gaseoso.
Este proceso se le puede aplicar al agua dulce y a la salada obteniéndose resultados diferentes teniendo en cuenta las sustancias producto.
Ejemplo
En el caso del agua salada las sustancias que se obtienen a través del ánodo y el cátodo son el cloro (Cl) y el hidrógeno (H) respectivamente ambos en estado gaseoso, quedando al final del proceso una disolución de hidróxido de sodio (NaOH).
AGUAS DURAS
Es aquella que contiene un alto nivel de minerales, concretamente de sales de magnesio y calcio. Este tipo de aguas suelen ser las subterráneas en suelos calcáreos, que elevan los niveles de cal y magnesio, entre otros.
Son aquellas que dificulta el desarrollo de espuma al estar en contacto con jabón, debido a que presenta una elevada cantidad de bicarbonatos y carbonatos de magnesio y de calcio. Para calcular la dureza del agua, se suelen sumar las concentraciones de magnesio y de calcio que están presentes en cada litro de agua.

La dureza del agua puede ser permanente o temporal. En el caso del agua dura permanente, por más que se hierva, los cloruros y los sulfatos de magnesio y de calcio se conservan ya que, después de alcanzar una determinada temperatura, su solubilidad comienza a disminuir.
También se puede definir la dureza de un agua como la suma de todas las sales de iones metálicos no alcalinos presentes en ella. En realidad, estamos hablando mayoritariamente de bicarbonatos de calcio y magnesio, aunque también entrarían sulfatos, cloruros, nitratos, fosfatos y silicatos de otros metales como bario, estroncio y otros metales minoritarios.
El agua dura temporal, en cambio, puede perder su dureza cuando se le añade hidróxido de calcio o cuando se hierve. Esto se debe a que sus carbonatos pueden disolverse y, por lo tanto, ser eliminados.
También se llama dureza temporal a la causada por el bicarbonato o carbonato ácido [Ca (HCO3)2], pues al calentar el agua se forma a partir de él carbonato de calcio (CaCO3), que es insoluble y forma depósitos en las superficies calientes. Estos depósitos se pueden formar en el fondo de los recipientes de cocina, en las resistencias para calentar el agua (termos, lavavajillas, lavadoras…), en conducciones calentadas, como las calderas, disminuyendo la transmisión térmica y pudiendo llegar a obturarlas.
AGUAS PESADAS
También se puede definir la dureza de un agua como la suma de todas las sales de iones metálicos no alcalinos presentes en ella. En realidad, estamos hablando mayoritariamente de bicarbonatos de calcio y magnesio, aunque también entrarían sulfatos, cloruros, nitratos, fosfatos y silicatos de otros metales como bario, estroncio y otros metales minoritarios.
El agua dura temporal, en cambio, puede perder su dureza cuando se le añade hidróxido de calcio o cuando se hierve. Esto se debe a que sus carbonatos pueden disolverse y, por lo tanto, ser eliminados.
También se llama dureza temporal a la causada por el bicarbonato o carbonato ácido [Ca (HCO3)2], pues al calentar el agua se forma a partir de él carbonato de calcio (CaCO3), que es insoluble y forma depósitos en las superficies calientes. Estos depósitos se pueden formar en el fondo de los recipientes de cocina, en las resistencias para calentar el agua (termos, lavavajillas, lavadoras…), en conducciones calentadas, como las calderas, disminuyendo la transmisión térmica y pudiendo llegar a obturarlas.
AGUAS PESADAS
Tiene mayor densidad) que la común. Un litro de agua pesada pesa 1.105 gramos, mientras que un litro de agua común pesa 1.000 gramos. Se denomina agua pesada (D2O) al óxido de deuterio.

Según los manuales, “a diferencia del agua común, que tiene dos átomos de hidrógeno, y uno de oxígeno, el agua pesada está formada por dos átomos de deuterio y uno de oxígeno”. Una vez que concluye el proceso, se la envasa en tambores o containers de aluminio. Es incolora e insípida.
El agua pesada es una molécula de composición química equivalente al agua, pero en la que los átomos de hidrógeno son sustituidos por deuterio, lo que altera algunas de sus propiedades y la torna más densa.
En palabras simples, la molécula de agua está formada por dos átomos de hidrógeno y uno de oxígeno (H2O), mientras que la molécula de agua pesada se compone de dos átomos de deuterio y uno de oxígeno (D2O).
Hidrógeno y deuterio son químicamente iguales, pero el átomo de hidrógeno no tiene neutrones en su núcleo y el deuterio tiene uno, por eso es más pesado y tiene las propiedades especiales del agua pesada.
En palabras simples, la molécula de agua está formada por dos átomos de hidrógeno y uno de oxígeno (H2O), mientras que la molécula de agua pesada se compone de dos átomos de deuterio y uno de oxígeno (D2O).
Hidrógeno y deuterio son químicamente iguales, pero el átomo de hidrógeno no tiene neutrones en su núcleo y el deuterio tiene uno, por eso es más pesado y tiene las propiedades especiales del agua pesada.
La principal aplicación tecnológica del agua pesada es como moderador y regulador en los reactores de uranio natural en los procesos de fisión nuclear, lo que permite que una central nuclear genere energía eléctrica
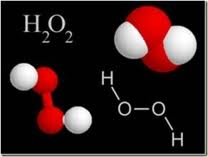
PERÓXIDO DE HIDRÓGENO

También conocido como agua oxigenada, dioxogen, óxido de agua o dioxidano, es un compuesto químico con características de un líquido altamente polar, fuertemente enlazado con el hidrógeno tal como el agua, pero que en general se presenta como un líquido ligeramente más viscoso que ésta. Es conocido por ser un poderoso oxidante.
A temperatura ambiente es un líquido incoloro con olor penetrante e incluso desagradable. Pequeñas cantidades de peróxido de hidrógeno gaseoso se encuentran naturalmente en el aire.
El peróxido de hidrógeno es muy inestable y se descompone lentamente en oxígeno y agua con liberación de gran cantidad de calor. Su velocidad de descomposición puede aumentar mucho en presencia de catalizadores. Aunque no es inflamable, es un agente oxidante potente que puede causar combustión espontánea cuando entra en contacto con materia orgánica o algunos metales, como el cobre, la plata o el bronce.
- OBTENCIÓN DEL PERÓXIDO DE HIDRÓGENO
Antiguamente el agua oxigenada era preparada por electrólisis de una solución acuosa de ácido sulfúrico o ácido de bisulfato de amonio (NH4HSO4), seguida por la hidrólisis del peroxodisulfato ((SO4)2).

En la actualidad el peróxido de hidrógeno se obtiene casi exclusivamente por la autooxidación de un 2-alcohol-antrahidroquinona (o 2-alco-9-10-dihidroxiantraceno) al correspondiente 2-alco antraquinona en un proceso llamado «proceso antraquinona».
En 1994, la producción mundial de H2O2 fue de 1,9 millones de toneladas y creció hasta 2,2 millones en 2006, la mayor parte con una concentración del 70 % o menos. En ese año el kilogramo de peróxido de hidrógeno se vendía a 1,5 dólares estadounidense.
- PROPIEDADES FÍSICAS
- El peróxido de hidrógeno, tiene ciertas características que lo diferencian de otras sustancias, como el hecho de ser un líquido sumamente polar, fuertemente oxidante, de olor particularmente penetrante, transparente pero ligeramente amarillento y un poco más denso que el agua, pero fácilmente miscible en ella.
- Es una sustancia inestable, que reacciona lentamente al calor, descomponiéndose en oxígeno y agua.
- No genera residuos que constituyan peligro para el medio ambiente, el reino animal o los seres humanos.
- Es un agente oxidante al contacto con ciertos elementos, si se utiliza solo, sin embargo, al ser mezclado con agentes oxidantes de mayor fuerza, entonces cumple la función de agente reductor.
- PROPIEDADES QUÍMICAS
- Densidad 1.406 kg/m3
- Peso Molecular 34.015 kg/Kg Mol
- Punto de fusión 262.15 k
- Punto de ebullición 423.35 k
- Temperatura Crítica 728 k
- Presión Crítica 22.000.000 Pa
- Densidad de vapor 423.35 kg/m
- Densidad relativa (agua=1) 1.4138
- Solubilidad 959 kg/m3
- APLICACIONES Y USOS
- MEDICINA
El agua oxigenada no falta en los botiquines de primeros auxilios, pero más allá de eso, este elemento es muy apreciado en las salas de intervenciones quirúrgicas, ya que constituye un potente agente germicida compuesto sólo de agua y oxígeno, el cual destruye, mediante oxidación, desinfectando heridas y previniendo contaminación de las mismas.


Odontología. Pala lograr un mejor y más duradero blanqueamiento de los dientes, los odontólogos utilizan el agua oxigenada como reactivo base para la realización de limpieza de dentaduras y desinfección bucal.
- ALIMENTOS
Como elemento preservativo y bactericida de las proteínas, como carne, pollo, pescado y algunos vegetales. El. Procedimiento es muy sencillo, solo debe agregarse unas gotas de peróxido de hidrógeno al agua de blanqueo y debido a su estructura, este se descompone con facilidad, sin representar peligro de intoxicación, pues, no llega a ser ingerido por el comensal. Sin embargo, algunos países como España, prohíben su uso como agente conservante, ya que en el proceso, se pueden perder algunas vitaminas vitales para el ser humano.
- ESTÉTICA
Bajo su presentación como agua oxigenada, ya sea de 20 ó 30 volúmenes, la podemos encontrar en los salones de belleza y es ampliamente conocida por todas aquellas personas, que han teñido o han realizado cualquier tratamiento químico en su cabello.
En este sentido el peróxido de hidrógeno, funciona como decolorante, ya que incide directamente en la transformación y descomposición de la melanina; como oxidante, por su participación, junto al tinte, en la obtención de un teñido uniforme; y como neutralizante, al equilibrar y reparar las conexiones de queratina rotos.
Restauración: su fuerte acción blanqueadora, convierte al peróxido de hidrógeno en un elemento de gran importancia, para quienes se dedican a la restauración de obras de arte antiguas, pues lo utilizan para convertir el sulfuro de plomo (oscuro y denso) en sulfato de plomo (blancuzco y ligero).
- INDUSTRIA
Se utilizan (entre muchas otras) para el blanqueamiento de fibras textiles, lo cual las prepara en función de su posterior teñido; las productoras de papel, lo usan para el blanqueo de la pulpa, en sustitución del cloro; también es un componente de combustible en la industria aeroespacial; y por último, en la fabricación de caucho y gomas; en el tratamiento de aguas contaminadas y, por supuesto, en la fabricación de productos para limpieza.
- USO DOMESTICO
Cuando hablamos del uso doméstico o casero del peróxido de hidrógeno, debemos tomar en cuenta los grados de concentración, ya que debe usarse a razón de 97% de agua y 3% de peróxido de hidrógeno, a fin de evitar accidentes y quemaduras por contacto. En todo caso, enumeremos algunas aplicaciones del agua oxigenada:
- Limpieza de baños, cocinas, baldosas, pisos y superficies en general
- Blanqueador, desodorizador, higienizante y quitamanchas
- Desinfectante de heridas y cicatrizante
- Previene y elimina hongos en piel y uñas.
- CONTAMINACIÓN DEL AGUA

La contaminación del agua o contaminación hídrica tiene lugar cuando en los cuerpos de agua naturales (lagos, ríos, mares, etc.) tienen presencia diversos tipos de sustancias químicas ajenas a su composición original, que modifican sus propiedades haciéndola insalubre, dañina para la vida, y por lo tanto inútil para la pesca, agricultura, recreación y consumo humano.
El agua es la sustancia líquida más abundante del planeta y el solvente universal presente en la mayoría de las sustancias y en todos los seres vivientes, que sin ella no podrían existir. La vida misma se originó en los mares de nuestro planeta.
El agua es la sustancia líquida más abundante del planeta y el solvente universal presente en la mayoría de las sustancias y en todos los seres vivientes, que sin ella no podrían existir. La vida misma se originó en los mares de nuestro planeta.
Sin embargo, eso no ha impedido que numerosas actividades humanas generen un impacto importante en la calidad del agua del planeta, mediante el desecho de sustancias líquidas, sólidas e incluso gaseosas en el ambiente. Y aunque también hay procesos naturales e iniciativas humanas que buscan contrarrestar la contaminación del agua, es mucho más sencillo ensuciarla que potabilizarla.
Según muchas organizaciones internacionales, la cantidad de agua potable disponible en el mundo vaticina futuras crisis de escasez. Según la ONU, un 3,1% de las personas que mueren anualmente en el planeta lo hacen por consumo de aguas contaminadas, lo que equivale a 2,2 millones de personas.
¿CUALES SON LOS PRINCIPALES CONTAMINANTES DEL AGUA?
¿CUALES SON LAS CAUSAS DE ESTA?
- El ser humano es el principal causante de la contaminación del agua, que puede verse afectada de muchas maneras: con el vertido de desechos industriales; por culpa del aumento de las temperaturas, que provocan la alteración del agua al disminuir el oxígeno en su composición; o a causa de la deforestación, que origina la aparición de sedimentos y bacterias bajo el suelo y la consiguiente contaminación del agua subterránea.
-De la misma manera, los pesticidas utilizados en los campos de cultivo agrícola se filtran por los canales subterráneos y llegan a las redes de consumo; y también con el vertido accidental de petróleo.
¿CUALES SON LAS CONSECUENCIAS DE LA CONTAMINACIÓN DEL AGUA?
¿COMO EVITAR ESTA CONTAMINACIÓN?
Para evitar o disminuir la contaminación del agua basta con tomar conciencia de ello y procurar su utilización más ahorrativa, eficiente y responsable. Esto pasa por:
- Políticas urbanas e industriales más responsables. Que obliguen a disponer de manera correcta de los subproductos de la industria y de las aguas servidas, atenuando el impacto que estos desechos infligen sobre el mar y los lagos.
- Campañas de concientización del consumo. El derroche de aguas potables es una realidad cotidiana, que va desde el grifo que queda abierto mientras nos enjabonamos las manos, hasta el agua potable que derrochamos “limpiando” la acera.
- Cultura de reciclaje. La disminución de la basura sólida que va a dar, de una forma u otra, al agua o a rellenos sanitarios en contacto con aguas subterráneas, puede darse mediante el reciclaje y un consumo más responsable.
Soluciones para la contaminación del agua
El agua contaminada a menudo tiene solución. Existen procesos de potabilización y limpieza tales como:
- Métodos de control bacteriológico y control biológico de las aguas.
- Tratamientos de aguas residuales y reutilización antes de devolverlas al mar.
- Mecanismos de filtrado de diversa índole.
- Combatir también la contaminación del aire y tierra
LOS LÍQUIDOS
INTRODUCCIÓN
El líquido es un estado de la materia, por el cual sus moléculas se adaptan al receptáculo que las contiene, están cerca unas de otras, con algunos huecos que permiten su fluidez, ejerciendo entre ellas mutuamente fuerzas de cohesión, y tienen tendencia a nivelarse. Se hallan en estado líquido el agua, el vino, el vinagre, etcétera. Los líquidos junto a los gases, conforman los fluidos.
Es un estado intermedio de agregación entre los gases y los sólidos.
Es un estado intermedio de agregación entre los gases y los sólidos.
El agua es el elemento más importante para la vida. Es de vital importancia para el ser humano, así como para el resto de animales y seres vivos que nos acompañan en el planeta Tierra. Resulta curioso que el 70 por ciento de la Tierra sea agua y que el 70 por ciento de nuestro cuerpo también sea agua.
OBJETIVOS
- Identificar las propiedades quimicas y biologicas de los liquidos.
- Describir la estructura molecular del agua y sus caracteristicas.
- Comprender el proceso del peroxido de hidrogeno.
- Reconocer y analizar la contaminación que se produce en el agua y tomar medidas.
MARCO TEÓRICO
Un líquido es un fluido que presenta un volumen constante en un rango amplio de presión. Es el único estado de agregación de la materia que presenta un volumen definido, pero nunca de manera fija.
PROPIEDADES
1) LA TENSIÓN SUPERFICIAL
La tensión superficial se debe a que las fuerzas que afectan a cada molécula son diferentes en el interior del líquido y en la superficie. Así, en el seno de un líquido cada molécula está sometida a fuerzas de atracción que en promedio se anulan. Esto permite que la molécula tenga una energía bastante baja. Sin embargo, en la superficie hay una fuerza neta hacia el interior del líquido. Rigurosamente, si en el exterior del líquido se tiene un gas, existirá una mínima fuerza atractiva hacia el exterior, aunque en la realidad esta fuerza es despreciable debido a la gran diferencia de densidades entre el líquido y gas.

Otra manera de verlo es que una molécula en contacto con su vecina está en un estado menor de energía que si no estuviera en contacto con dicha vecina. Las moléculas interiores tienen todas las moléculas vecinas que podrían tener, pero las partículas del contorno tienen menos partículas vecinas que las interiores y por eso tienen un estado más alto de energía. Para el líquido, el disminuir su estado energético es minimizar el número de partículas en su superficie.
Energéticamente, las moléculas situadas en la superficie tiene una mayor energía promedio que las situadas en el interior, por lo tanto la tendencia del sistema será disminuir la energía total, y ello se logra disminuyendo el número de moléculas situadas en la superficie, de ahí la reducción de área hasta el mínimo posible.
2) FLUIDEZ
Esta propiedad hace que los líquidos puedan pasar fácilmente a través de un agujero sin importar su tamaño, siempre y cuando este agujero se encuentre a un inferior o el mismo nivel del recipiente en donde se está almacenado el líquido.
Esta propiedad hace que los líquidos puedan pasar fácilmente a través de un agujero sin importar su tamaño, siempre y cuando este agujero se encuentre a un inferior o el mismo nivel del recipiente en donde se está almacenado el líquido.
Esta propiedad indica la capacidad de deformación de un líquido la cual es muy amplia sin requerir de una tensión mecánica.
Tambièn es una característica de los líquidos o gases que les confiere la habilidad de poder pasar por cualquier orificio o agujero por más pequeño que sea, siempre que esté a un mismo nivel del recipiente en el que se encuentren el líquido a diferencia del restante estado de agregación conocido como sólido.
.
Tambièn es una característica de los líquidos o gases que les confiere la habilidad de poder pasar por cualquier orificio o agujero por más pequeño que sea, siempre que esté a un mismo nivel del recipiente en el que se encuentren el líquido a diferencia del restante estado de agregación conocido como sólido.
.
La fluidez se debe a que un fluido puede adquirir una deformación arbitrariamente grande sin necesidad de ejercer una tensión mecánica los líquidos la tensión mecánica o presión en el seno del fluido depende esencialmente de la velocidad de la deformación no de la deformación en sí misma a diferencia de los sólidos que tienen memoria de forma y experimentan tensiones tanto más grandes cuanto más se alejan de la forma original, es decir, en un sólido la tensión está relacionada primordialmente con el grado de deformación.

La viscosidad de un líquido crece al aumentar su masa molar y disminuye al crecer la temperatura. También está relacionada con la complejidad de las moléculas que constituyen el líquido: es baja en los gases inertes licuados y alta en los aceites pesados.
Es una propiedad característica de todo fluido (líquidos o gases).
La viscosidad es una medida de la resistencia al desplazamiento de un fluido cuando existe una diferencia de presión.
Cuando un líquido o un gas fluyen se supone la existencia de una capa estacionaria, de líquido o gas, adherida sobre la superficie del material a través del cual se presenta el flujo. La segunda capa roza con la adherida superficialmente y esta segunda con una tercera y así sucesivamente. Este roce entre las capas sucesivas es el responsable de la oposición al flujo, o sea, el responsable de la viscosidad.
La viscosidad se mide en poises, siendo un poise la viscosidad de un líquido en el que para deslizar una capa de un centímetro cuadrado de área a la velocidad de 1 cm/s respecto a otra estacionaria situado a 1 cm de distancia fuese necesaria la fuerza de una dina.
La viscosidad suele decrecer en los líquidos al aumentar la temperatura, aunque algunos pocos líquidos presentan un aumento de viscosidad cuando se calientan. Para los gases la viscosidad aumenta al aumentar la temperatura.
La viscosidad de un líquido se determina por medio de un viscosímetro entre los cuales el más utilizado es el de Ostwald. Este se utiliza para determinar viscosidad relativa, es decir, que conociendo la viscosidad de un líquido patrón, generalmente agua, se obtiene la viscosidad del líquido problema a partir de la ecuación:


4) PRESIÓN DE VAPOR
La presión de vapor es una propiedad de todo líquido que dependerá directamente de la temperatura, de igual forma sucede con el calor de vaporización, el punto de solidificación y el punto de ebullición.
Un líquido puede ser sobrecalentado indicando así que ha pasado su punto de ebullición; o puede ser superenfriado, indicando que está por debajo de su punto de congelación.
Cuando la velocidad de las moléculas que abandonan la superficie del líquido (evaporación) es igual a la velocidad de las moléculas que regresan al líquido (condensación), se establece un equilibrio dinámico. En este momento ya no se modifica la cantidad de moléculas en el estado vapor.
El vapor ejerce entonces una presión constante conocida como presión de vapor del líquido.
La presión de vapor de un líquido depende de la temperatura: a mayor T,mayor es la Pvapor.
5) PUNTO DE EBULLICIÓN
Refiere a la temperatura donde la presión de vapor del líquido es la misma que la presión atmosférica, o sea, que la presión que se se ejerce sobre dicho líquido. Un líquido llega a presentar diferentes puntos de ebullición según las condición de presión en la cual se encuentre.
El punto normal de ebullición es de 760 mm de Hg, lo cual equivale a 1 atm.
Calor de vaporización, es una medida de la intensidad de las fuerzas intermoleculares que se ejercen en un líquido. Se define como la cantidad de calor necesario para pasar una cantidad de una sustancia, del estado líquido al estado gaseoso, a la temperatura de ebullición.

6) EVAPORACIÓN
Generalmente, la evaporación puede verse por la desaparición gradual del líquido cuando se expone a un volumen significativo de gas. Por término medio, las moléculas no tienen bastante energía para escaparse del líquido, porque de lo contrario el líquido se convertiría en vapor rápidamente. Cuando las moléculas chocan, se transfieren la energía de una a otra en grados variantes según el modo en que chocan.
Los líquidos que no parecen evaporarse visiblemente a una temperatura dada en un gas determinado (p. ej., el aceite de cocina a temperatura ambiente) poseen moléculas que no tienden a transferirse la energía de una a otra como para darle "la velocidad de escape" (la energía calórica) necesaria para convertirse en vapor. Sin embargo, estos líquidos se evaporan, pero el proceso es mucho más lento y considerablemente menos visible.
La evaporación también tiende a producirse más rápidamente con tasas de flujo más altas entre la fase gaseosa y líquida, y en líquidos con presión de vapor más alta.
7) CAPILARIDAD
La capilaridad es una propiedad de los líquidos que depende de su tensión superficial. Las fuerzas entre las moléculasde un líquido se llaman fuerzas de cohesión y, aquellas entre las moléculas del líquido y las de la superficie de un sólido, se denominan fuerzas de adhesión, lo que les permite ascender por un tubo capilar (de diámetro muy pequeño).

Cuando un líquido sube por un tubo capilar, es debido a que la fuerza de cohesión es menor a la adhesión del líquido con el material del tubo. El líquido sigue subiendo hasta que la tensión superficial es equilibrada por el peso del líquido que llena el tubo. Éste es el caso del agua y, ésta propiedad es la que regula parcialmente su ascenso dentro de las plantas, sin gastar energía para vencer la gravedad.
Sin embargo, cuando la cohesión entre las moléculas de un líquido es más potente que la adhesión al capilar (como el caso del mercurio), la tensión superficial hace que el líquido descienda a un nivel inferior y su superficie es convexa.
La masa líquida es inversamente proporcional al cuadrado del diámetro del tubo, por lo que un tubo angosto succionará el líquido en una longitud mayor que un tubo ancho
La masa líquida es inversamente proporcional al cuadrado del diámetro del tubo, por lo que un tubo angosto succionará el líquido en una longitud mayor que un tubo ancho
AGUA
ESTRUCTURA MOLECULAR
El agua está compuesta por un átomo de oxígeno y dos de hidrógeno. Cada átomo de hidrógeno se encuentra unido covalentemente al oxígeno por medio de un par de electrones de enlace. El oxígeno tiene además dos pares de electrones no enlazantes. De esta manera existen cuatro pares de electrones rodeando al átomo de oxígeno: dos pares formando parte de los enlaces covalentes con los átomos de hidrógeno y dos pares no compartidos en el lado opuesto. El oxígeno es un átomo electronegativo o "amante" de los electrones, a diferencia del hidrógeno.
El agua es una molécula "polar"; es decir, existe en ella una distribución irregular de la densidad electrónica.

PROPIEDADES QUÍMICAS
- Elevada fuerza de cohesión entre sus moléculas: debido a los puentes de hidrógeno que se establecen las moléculas de agua permanecen unidas entre sí de forma más intensa que en otros compuestos similares.
- El agua es un líquido prácticamente incompresible: no es fácil reducir su volumen mediante presión, pues las moléculas de agua están enlazadas entre sí manteniendo unas distancias intermoleculares más o menos fijas. Por ello muchos organismos usan agua para fabricar sus esqueletos hidrostáticos, como los anélidos y celentéreos.
- Elevada tensión superficial: su superficie opone gran resistencia a romperse, lo que permite que muchos organismos puedan “andar” sobre el agua y vivan asociados a esa película superficial.
- Capilaridad: ascenso de la columna de agua a través de tubos de diámetro capilar, fenómeno que depende de la capacidad de adhesión de las moléculas de agua a las paredes de los conductos capilares y de la cohesión de las moléculas de agua entre si. Las plantas utilizan esta propiedad para la ascensión de la sabia bruta por el xilema.
- Elevado calor específico: Hace falta mucha energía para elevar su temperatura. esto convierte al agua en un buen aislante térmico.
- Elevado calor de vaporización: debido a que para pasar al estado sólido parte de la energía suministrada se emplea en romper los enlaces de puentes de hidrógeno.
- Mayor densidad en estado liquido que en estado sólido: el hielo flota en el agua.
- Elevada constante dieléctrica. Al ser un dipolo el agua se convierte en el gran disolvente universal: compuestos iónicos y polares se disuelven fácilmente en agua.
- Bajo grado de ionización: sólo una de cada 551.000.000 moléculas de agua se encuentra disociada en forma iónica. La concentración de iones hidroxilo (OH-1) y de iones de hidrógeno (protones) H+ es la misma 10-7 molar. El agua es desde el punto de vista del pH, neutra.
Hay que tener lo siguente
PROPIEDADES BIOLÓGICAS
• Es el disolvente de numerosas sustancias.
• Es el medio donde se realizan las reacciones metabólicas.
• Posee una función activa en la estructura celular.
• Tiene función mecánica amortiguadora en el interior del organismo.
• Participa como “vehículo” en el transporte de sustancias en el interior del organismo y en su intercambio con el medio ambiente.
• Contribuye a la regulación de la temperatura corporal.
• Es el hábitat de muchas especies.
ELECTROLICIS DEL H2O
• Es el disolvente de numerosas sustancias.
• Es el medio donde se realizan las reacciones metabólicas.
• Posee una función activa en la estructura celular.
• Tiene función mecánica amortiguadora en el interior del organismo.
• Participa como “vehículo” en el transporte de sustancias en el interior del organismo y en su intercambio con el medio ambiente.
• Contribuye a la regulación de la temperatura corporal.
• Es el hábitat de muchas especies.
ELECTROLICIS DEL H2O
La electrólisis es un proceso electroquímico de oxidación-reducción que ocurre al pasar la energía eléctrica a través de un electrólito fundido o disolución acuosa.
En el caso del agua para que este proceso ocurra se deben cumplir las siguientes condiciones:
- El agua no puede estar en estado puro, o sea debe tener pequeñas concentraciones de sales u otros minerales.
- Se debe usar corriente directa en este proceso.

La electrólisis del agua permite que se obtenga los elementos químicos que la componen de forma pura o sea el hidrógeno(H) a través del cátodo y el oxígeno(O) a través del ánodo, ambos en estado gaseoso.
Este proceso se le puede aplicar al agua dulce y a la salada obteniéndose resultados diferentes teniendo en cuenta las sustancias producto.
Ejemplo
En el caso del agua salada las sustancias que se obtienen a través del ánodo y el cátodo son el cloro (Cl) y el hidrógeno (H) respectivamente ambos en estado gaseoso, quedando al final del proceso una disolución de hidróxido de sodio (NaOH).
AGUAS DURAS
Es aquella que contiene un alto nivel de minerales, concretamente de sales de magnesio y calcio. Este tipo de aguas suelen ser las subterráneas en suelos calcáreos, que elevan los niveles de cal y magnesio, entre otros.
Son aquellas que dificulta el desarrollo de espuma al estar en contacto con jabón, debido a que presenta una elevada cantidad de bicarbonatos y carbonatos de magnesio y de calcio. Para calcular la dureza del agua, se suelen sumar las concentraciones de magnesio y de calcio que están presentes en cada litro de agua.

La dureza del agua puede ser permanente o temporal. En el caso del agua dura permanente, por más que se hierva, los cloruros y los sulfatos de magnesio y de calcio se conservan ya que, después de alcanzar una determinada temperatura, su solubilidad comienza a disminuir.
También se puede definir la dureza de un agua como la suma de todas las sales de iones metálicos no alcalinos presentes en ella. En realidad, estamos hablando mayoritariamente de bicarbonatos de calcio y magnesio, aunque también entrarían sulfatos, cloruros, nitratos, fosfatos y silicatos de otros metales como bario, estroncio y otros metales minoritarios.
El agua dura temporal, en cambio, puede perder su dureza cuando se le añade hidróxido de calcio o cuando se hierve. Esto se debe a que sus carbonatos pueden disolverse y, por lo tanto, ser eliminados.
También se llama dureza temporal a la causada por el bicarbonato o carbonato ácido [Ca (HCO3)2], pues al calentar el agua se forma a partir de él carbonato de calcio (CaCO3), que es insoluble y forma depósitos en las superficies calientes. Estos depósitos se pueden formar en el fondo de los recipientes de cocina, en las resistencias para calentar el agua (termos, lavavajillas, lavadoras…), en conducciones calentadas, como las calderas, disminuyendo la transmisión térmica y pudiendo llegar a obturarlas.
AGUAS PESADAS
También se puede definir la dureza de un agua como la suma de todas las sales de iones metálicos no alcalinos presentes en ella. En realidad, estamos hablando mayoritariamente de bicarbonatos de calcio y magnesio, aunque también entrarían sulfatos, cloruros, nitratos, fosfatos y silicatos de otros metales como bario, estroncio y otros metales minoritarios.
El agua dura temporal, en cambio, puede perder su dureza cuando se le añade hidróxido de calcio o cuando se hierve. Esto se debe a que sus carbonatos pueden disolverse y, por lo tanto, ser eliminados.
También se llama dureza temporal a la causada por el bicarbonato o carbonato ácido [Ca (HCO3)2], pues al calentar el agua se forma a partir de él carbonato de calcio (CaCO3), que es insoluble y forma depósitos en las superficies calientes. Estos depósitos se pueden formar en el fondo de los recipientes de cocina, en las resistencias para calentar el agua (termos, lavavajillas, lavadoras…), en conducciones calentadas, como las calderas, disminuyendo la transmisión térmica y pudiendo llegar a obturarlas.
AGUAS PESADAS
Tiene mayor densidad) que la común. Un litro de agua pesada pesa 1.105 gramos, mientras que un litro de agua común pesa 1.000 gramos. Se denomina agua pesada (D2O) al óxido de deuterio.

Según los manuales, “a diferencia del agua común, que tiene dos átomos de hidrógeno, y uno de oxígeno, el agua pesada está formada por dos átomos de deuterio y uno de oxígeno”. Una vez que concluye el proceso, se la envasa en tambores o containers de aluminio. Es incolora e insípida.
El agua pesada es una molécula de composición química equivalente al agua, pero en la que los átomos de hidrógeno son sustituidos por deuterio, lo que altera algunas de sus propiedades y la torna más densa.
En palabras simples, la molécula de agua está formada por dos átomos de hidrógeno y uno de oxígeno (H2O), mientras que la molécula de agua pesada se compone de dos átomos de deuterio y uno de oxígeno (D2O).
Hidrógeno y deuterio son químicamente iguales, pero el átomo de hidrógeno no tiene neutrones en su núcleo y el deuterio tiene uno, por eso es más pesado y tiene las propiedades especiales del agua pesada.
En palabras simples, la molécula de agua está formada por dos átomos de hidrógeno y uno de oxígeno (H2O), mientras que la molécula de agua pesada se compone de dos átomos de deuterio y uno de oxígeno (D2O).
Hidrógeno y deuterio son químicamente iguales, pero el átomo de hidrógeno no tiene neutrones en su núcleo y el deuterio tiene uno, por eso es más pesado y tiene las propiedades especiales del agua pesada.
La principal aplicación tecnológica del agua pesada es como moderador y regulador en los reactores de uranio natural en los procesos de fisión nuclear, lo que permite que una central nuclear genere energía eléctrica
PERÓXIDO DE HIDRÓGENO

También conocido como agua oxigenada, dioxogen, óxido de agua o dioxidano, es un compuesto químico con características de un líquido altamente polar, fuertemente enlazado con el hidrógeno tal como el agua, pero que en general se presenta como un líquido ligeramente más viscoso que ésta. Es conocido por ser un poderoso oxidante.
A temperatura ambiente es un líquido incoloro con olor penetrante e incluso desagradable. Pequeñas cantidades de peróxido de hidrógeno gaseoso se encuentran naturalmente en el aire.
El peróxido de hidrógeno es muy inestable y se descompone lentamente en oxígeno y agua con liberación de gran cantidad de calor. Su velocidad de descomposición puede aumentar mucho en presencia de catalizadores. Aunque no es inflamable, es un agente oxidante potente que puede causar combustión espontánea cuando entra en contacto con materia orgánica o algunos metales, como el cobre, la plata o el bronce.
- OBTENCIÓN DEL PERÓXIDO DE HIDRÓGENO
Antiguamente el agua oxigenada era preparada por electrólisis de una solución acuosa de ácido sulfúrico o ácido de bisulfato de amonio (NH4HSO4), seguida por la hidrólisis del peroxodisulfato ((SO4)2).

En la actualidad el peróxido de hidrógeno se obtiene casi exclusivamente por la autooxidación de un 2-alcohol-antrahidroquinona (o 2-alco-9-10-dihidroxiantraceno) al correspondiente 2-alco antraquinona en un proceso llamado «proceso antraquinona».
En 1994, la producción mundial de H2O2 fue de 1,9 millones de toneladas y creció hasta 2,2 millones en 2006, la mayor parte con una concentración del 70 % o menos. En ese año el kilogramo de peróxido de hidrógeno se vendía a 1,5 dólares estadounidense.
- PROPIEDADES FÍSICAS
- El peróxido de hidrógeno, tiene ciertas características que lo diferencian de otras sustancias, como el hecho de ser un líquido sumamente polar, fuertemente oxidante, de olor particularmente penetrante, transparente pero ligeramente amarillento y un poco más denso que el agua, pero fácilmente miscible en ella.
- Es una sustancia inestable, que reacciona lentamente al calor, descomponiéndose en oxígeno y agua.
- No genera residuos que constituyan peligro para el medio ambiente, el reino animal o los seres humanos.
- Es un agente oxidante al contacto con ciertos elementos, si se utiliza solo, sin embargo, al ser mezclado con agentes oxidantes de mayor fuerza, entonces cumple la función de agente reductor.
- PROPIEDADES QUÍMICAS
- Densidad 1.406 kg/m3
- Peso Molecular 34.015 kg/Kg Mol
- Punto de fusión 262.15 k
- Punto de ebullición 423.35 k
- Temperatura Crítica 728 k
- Presión Crítica 22.000.000 Pa
- Densidad de vapor 423.35 kg/m
- Densidad relativa (agua=1) 1.4138
- Solubilidad 959 kg/m3
- APLICACIONES Y USOS
- MEDICINA
El agua oxigenada no falta en los botiquines de primeros auxilios, pero más allá de eso, este elemento es muy apreciado en las salas de intervenciones quirúrgicas, ya que constituye un potente agente germicida compuesto sólo de agua y oxígeno, el cual destruye, mediante oxidación, desinfectando heridas y previniendo contaminación de las mismas.


Odontología. Pala lograr un mejor y más duradero blanqueamiento de los dientes, los odontólogos utilizan el agua oxigenada como reactivo base para la realización de limpieza de dentaduras y desinfección bucal.
- ALIMENTOS
Como elemento preservativo y bactericida de las proteínas, como carne, pollo, pescado y algunos vegetales. El. Procedimiento es muy sencillo, solo debe agregarse unas gotas de peróxido de hidrógeno al agua de blanqueo y debido a su estructura, este se descompone con facilidad, sin representar peligro de intoxicación, pues, no llega a ser ingerido por el comensal. Sin embargo, algunos países como España, prohíben su uso como agente conservante, ya que en el proceso, se pueden perder algunas vitaminas vitales para el ser humano.
- ESTÉTICA
Bajo su presentación como agua oxigenada, ya sea de 20 ó 30 volúmenes, la podemos encontrar en los salones de belleza y es ampliamente conocida por todas aquellas personas, que han teñido o han realizado cualquier tratamiento químico en su cabello.
En este sentido el peróxido de hidrógeno, funciona como decolorante, ya que incide directamente en la transformación y descomposición de la melanina; como oxidante, por su participación, junto al tinte, en la obtención de un teñido uniforme; y como neutralizante, al equilibrar y reparar las conexiones de queratina rotos.
Restauración: su fuerte acción blanqueadora, convierte al peróxido de hidrógeno en un elemento de gran importancia, para quienes se dedican a la restauración de obras de arte antiguas, pues lo utilizan para convertir el sulfuro de plomo (oscuro y denso) en sulfato de plomo (blancuzco y ligero).
- INDUSTRIA
Se utilizan (entre muchas otras) para el blanqueamiento de fibras textiles, lo cual las prepara en función de su posterior teñido; las productoras de papel, lo usan para el blanqueo de la pulpa, en sustitución del cloro; también es un componente de combustible en la industria aeroespacial; y por último, en la fabricación de caucho y gomas; en el tratamiento de aguas contaminadas y, por supuesto, en la fabricación de productos para limpieza.
- USO DOMESTICO
Cuando hablamos del uso doméstico o casero del peróxido de hidrógeno, debemos tomar en cuenta los grados de concentración, ya que debe usarse a razón de 97% de agua y 3% de peróxido de hidrógeno, a fin de evitar accidentes y quemaduras por contacto. En todo caso, enumeremos algunas aplicaciones del agua oxigenada:
- Limpieza de baños, cocinas, baldosas, pisos y superficies en general
- Blanqueador, desodorizador, higienizante y quitamanchas
- Desinfectante de heridas y cicatrizante
- Previene y elimina hongos en piel y uñas.
- CONTAMINACIÓN DEL AGUA

agua
Sin embargo, eso no ha impedido que numerosas actividades humanas generen un impacto importante en la calidad del agua del planeta, mediante el desecho de sustancias líquidas, sólidas e incluso gaseosas en el ambiente. Y aunque también hay procesos naturales e iniciativas humanas que buscan contrarrestar la contaminación del agua, es mucho más sencillo ensuciarla que potabilizarla.
Según muchas organizaciones internacionales, la cantidad de agua potable disponible en el mundo vaticina futuras crisis de escasez. Según la ONU, un 3,1% de las personas que mueren anualmente en el planeta lo hacen por consumo de aguas contaminadas, lo que equivale a 2,2 millones de personas.
¿CUALES SON LOS PRINCIPALES CONTAMINANTES DEL AGUA?
¿CUALES SON LAS CAUSAS DE ESTA?
- El ser humano es el principal causante de la contaminación del agua, que puede verse afectada de muchas maneras: con el vertido de desechos industriales; por culpa del aumento de las temperaturas, que provocan la alteración del agua al disminuir el oxígeno en su composición; o a causa de la deforestación, que origina la aparición de sedimentos y bacterias bajo el suelo y la consiguiente contaminación del agua subterránea.
-De la misma manera, los pesticidas utilizados en los campos de cultivo agrícola se filtran por los canales subterráneos y llegan a las redes de consumo; y también con el vertido accidental de petróleo.
¿CUALES SON LAS CONSECUENCIAS DE LA CONTAMINACIÓN DEL AGUA?
¿COMO EVITAR ESTA CONTAMINACIÓN?
Para evitar o disminuir la contaminación del agua basta con tomar conciencia de ello y procurar su utilización más ahorrativa, eficiente y responsable. Esto pasa por:
- Políticas urbanas e industriales más responsables. Que obliguen a disponer de manera correcta de los subproductos de la industria y de las aguas servidas, atenuando el impacto que estos desechos infligen sobre el mar y los lagos.
- Campañas de concientización del consumo. El derroche de aguas potables es una realidad cotidiana, que va desde el grifo que queda abierto mientras nos enjabonamos las manos, hasta el agua potable que derrochamos “limpiando” la acera.
- Cultura de reciclaje. La disminución de la basura sólida que va a dar, de una forma u otra, al agua o a rellenos sanitarios en contacto con aguas subterráneas, puede darse mediante el reciclaje y un consumo más responsable.
Soluciones para la contaminación del agua
El agua contaminada a menudo tiene solución. Existen procesos de potabilización y limpieza tales como:
- Métodos de control bacteriológico y control biológico de las aguas.
- Tratamientos de aguas residuales y reutilización antes de devolverlas al mar.
- Mecanismos de filtrado de diversa índole.
- Combatir también la contaminación del aire y tierra
WEBGRAFÌA
https://www.ecured.cu/Agua_dura
https://definicion.de/agua-dura/
http://corinto.pucp.edu.pe/quimicageneral/contenido/54-propiedades-de-los-liquidos.html
https://www.tutareaescolar.com/propiedades-de-los-liquidos.html
https://www.tutareaescolar.com/propiedades-de-los-liquidos.html
https://www.ciclohidrologico.com/evaporacin
http://www.atl.org.mx/index.php?option=com_content&view=article&id=1992:propiedades-quimicas-del-agua&catid=72:ciencias-naturales&Itemid=480
https://diverquim.files.wordpress.com/2014/06/propiedades-quc3admicas-y-biolc3b3gicas-del-agua.pdf
https://es.wikipedia.org/wiki/Líquido#Fluidez
https://es.wikipedia.org/wiki/Tensión_superficial
http://www.aloas.org/noticias/Pages/¿Qué-es-el-agua-pesada.aspx
https://www.peroxidodehidrogeno.net
https://concepto.de/contaminacion-del-agua/#ixzz5xrz6W200
https://www.sostenibilidad.com/agua/causas-consecuencias-contaminacion-agua/#a1


PUDO CONSULTAR UN POCO MÁS 4,3
ResponderEliminar