GASES, LÍQUIDOS
ERIKA LORENA VALENCIA MARTINEZ
10 - 1
INSTITUCIÓN EDUCATIVA EXALUMNAS DE LA PRESENTACIÓN
2019
De los minerales que contienen oxígeno, los más importantes son los que contienen silicio, siendo el más simple de todos la sílice (SiO2), que es el principal constituyente de la arena. Otros compuestos que contienen oxígeno son sulfatos, carbonatos, fosfatos, nitratos y óxidos, principalmente.

El ozono se usa como germicida, como decolorante de ceras, féculas, grasas y barnices.

El O2 concentrado permite una combustión rápida y enérgica. Las tuberías y los recipientes de acero usados para almacenar y trasmitir tanto el oxígeno líquido como el gaseoso actúan como combustible; por tanto, el diseño y la fabricación de los sistemas de O2 requieren una atención especial para asegurar que las fuentes de ignición se minimizan.

Las reacciones de combustión a menudo transcurren mediante la formación de radicales libres, moléculas o iones electrónicamente excitados que emiten fluorescencia dando color a la llama, o también formando pequeñas partículas de sólido (ejem. carbón) cuya incandescencia puede observarse.



Es un fenómeno luminoso que se produce por la incandescencia de los gases durante la combustión.
Para que la llama comience y quede estable, se debe estabilizar el frente de llama. Para ello, se debe coordinar la velocidad de escape de gases y de propagación de la llama con la entrada de comburente (aire) y combustible. El frente de llama marca la separación entre el gas quemado y el gas sin quemar. Aquí es donde tienen lugar las reacciones de oxidación principales.
La propagación de la llama es el desplazamiento de ésta a través de la masa gaseosa. Se efectúa esta propagación en el frente de llama Si la combustión se efectúa con suficiente, oxígeno, es completa.
Si falta oxígeno, la combustión es incompleta y la temperatura que se alcanza es mas baja; en esta llama se reducen los óxidos de algunos metales; la llama que se produce tiene una luminosidad característica a causa de la incandescencia del carbón que no se quema por falta de oxígeno. Esta llama se conoce con el nombre de llama de reducción.
La forma que presenta una llama depende del medio técnico que prepara el combustible/comburente; es decir, depende del quemador utilizado, ya que éste es el encargado de pulverizar y repartir el combustible. Si la combustión es buena, la llama no será opaca, negruzca,... El color negro lo van a dar los inquemados.

Las llamas se clasifican en 2 grupos:
El 55 % de la producción mundial de oxígeno se consume en la producción de acero. Otro 25 % se dedica a la industria química. Del 20 % restante la mayor parte se usa para aplicaciones medicinales, oxicorte, como oxidante en combustible de cohetes y en tratamiento de aguas.

- En la respiración
Las plantas, animales y los seres humanos dependen del oxígeno para respirar. El oxígeno inhalado penetra en los pulmones y alcanza los alvéolos. Las capas de células que revisten los alvéolos y los capilares circundantes se disponen ocupando el espesor de una sola célula y están en contacto estrecho unas con otras. Esta barrera entre el aire y la sangre tiene un grosor aproximado de una micra (1/10 000 cm). El oxígeno atraviesa rápidamente esta barrera aire–sangre y llega hasta la sangre que circula por los capilares. Igualmente, el dióxido de carbono pasa de la sangre al interior de los alvéolos, desde donde es exhalado al exterior.
El propósito esencial de la respiración es tomar el O2 del aire y, en medicina, se usan suplementos de oxígeno. El tratamiento no solo incrementa los niveles de oxígeno en la sangre del paciente, sino que tiene el efecto secundario de disminuir la resistencia al flujo de la sangre en muchos tipos de pulmones enfermos, lo que facilita el trabajo de bombeo del corazón. La oxigenoterapia se usa para tratar el enfisema, la neumonía, algunas insuficiencias cardíacas, algunos desórdenes que causan una elevada presión arterial pulmonary cualquier enfermedad que afecte a la capacidad del cuerpo para tomar y usar el oxígeno.
Los tratamientos son lo suficientemente flexibles como para ser usados en hospitales, la vivienda del paciente o, cada vez más, con instrumentos móviles. Así, las tiendas de oxígeno se solían usar como suplementos de oxígeno, pero han ido sustituyéndose por las máscaras de oxígeno y las cánulas nasales.
La medicina hiperbárica (de alta presión) usa cámaras especiales de oxígeno para aumentar la presión parcial del O2 en el paciente y, cuando son necesarias, en el personal médico.
La intoxicación por monóxido de carbono, la mionecrosis
(gangrena gaseosa) y el síndrome de descompresión a veces se tratan con estos aparatos. El aumento de la concentración del O2 en los pulmones ayuda a desplazar el monóxido de carbono del hemogrupo de hemoglobina.
El oxígeno es tóxico para la bacteria anaerobia que causa la gangrena gaseosa, de manera que aumentar su presión parcial ayuda a acabar con ellas.
También se usa oxígeno para pacientes que necesitan
ventilación mecánica, normalmente a concentraciones superiores al 21 % encontrado en el aire ambiental
- En el apoyo vital y uso recreativo
Una aplicación notable del O2 como gas respirable de baja presión se encuentra en los trajes espaciales modernos, que envuelven el cuerpo de sus ocupantes con aire presurizado. Estos dispositivos usan oxígeno casi puro a una presión de alrededor de un tercio de la común, lo que da como resultado una presión parcial normal en el O2 de la sangre.
Este intercambio de oxígeno de alta concentración para una baja presión es necesario para mantener la flexibilidad de los trajes espaciales.



El oxígeno presenta dos bandas de absorción



INTRODUCCIÓN
En este trabajo se dará a conocer la definición de los gases como el oxigeno y el hidrógeno, sus características, propiedades físicas y químicas.
El oxígeno es el elemento químico más abundante, por masa, en la biosfera, el aire, el mar y el suelo terrestres. Es, asimismo, el tercero más abundante en el universo, tras el hidrógeno y el helio. Alrededor del 0,9 % de la masa del Sol es oxígeno; que constituye también el 49,2 % de la masa de la corteza terrestre, y es el principal componente de los océanos de la Tierra (88,8 % de su masa total).
El oxigeno es el elemento químico de numero atómico 8, masa atómica 15,99 y símbolo O ; es un gas incoloro e inodoro que se encuentra en el aire, en el agua, en los seres vivos y en la mayor parte de los compuestos orgánicos e inorgánicos; es esencial en la respiración y en la combustión, se usa en soldaduras y se administra a pacientes con problemas respiratorios o a personas que vuelan a altitudes elevadas.
El hidrógeno es el elemento químico de número atómico 1, representado por el símbolo H. Con una masa atómica de 1,00797, es el más ligero de la tabla periódica de los elementos. Por lo general, se presenta en su forma molecular, formando el gas diatómico H2 en condiciones normales. Este gas es inflamable, incoloro, inodoro, no metálico e insoluble en agua.
El hidrógeno elemental es relativamente raro en la Tierra y es producido industrialmente a partir de hidrocarburos como, por ejemplo, el metano. La mayor parte del hidrógeno elemental se obtiene in sitú, es decir, en el lugar y en el momento en que se necesita.
OBJETIVOS
- Identificar las propiedades físicas y químicas de los gases (oxigeno e hidrógeno).
- Aprender y conocer como se lleva a cabo el proceso de combustión con cada uno de los gases ya mencionados.
- Comprender la importancia de la llama para el proceso del oxigeno e hidrógeno.
- Reconocer las aplicaciones y usos de los elementos mencionados.
MARCO TEÓRICO
OXIGENO
- ¿QUÉ ES?
Es el elemento químico de numero atómico 8, masa atómica 15,99 y símbolo O ; es un gas incoloro e inodoro que se encuentra en el aire, en el agua, en los seres vivos y en la mayor parte de los compuestos orgánicos e inorgánicos; es esencial en la respiración y en la combustión, se usa en soldaduras y se administra a pacientes con problemas respiratorios o a personas que vuelan a altitudes elevadas.
Este se encuentra en todos los seres vivientes, siendo necesario para respirar, ya que el aire está integrado por una mezcla de gases fundamentalmente nitrógeno y oxígeno (21 %). Además sin oxígeno sería imposible asimilar la comida ya que permite la combustión celular interna. Está en el agua, en el 50 % de la corteza terrestre, en los óxidos y en los ácidos.
- ESTADO NATURAL
También es un elemento gaseoso ligeramente Magnético, incoloro, inodoro e insípido; es vital en el Ciclo energético de los seres vivos y esencial en la respiración celular de los organismos aeróbicos. Es más electronegativo que cualquier otro elemento, excepto el Flúor y forma compuestos con todos menos con los Gases nobles o inertes.
El Oxígeno es el elemento más abundante de la superficie terrestre, de la cual forma casi el 50%; constituye un 89% del agua y un 23% del aire (porcentajes por pesos).
En estado libre, el oxígeno se encuentra en la atmósfera en forma de moléculas diatónicas (O2), constituyendo un 23% por peso y un 21% por volumen. En combinación, entra en la formación de una gran cantidad de compuestos orgánicos y minerales, haciendo parte de todos los organismos animales y vegetales.
En estado libre, el oxígeno se encuentra en la atmósfera en forma de moléculas diatónicas (O2), constituyendo un 23% por peso y un 21% por volumen. En combinación, entra en la formación de una gran cantidad de compuestos orgánicos y minerales, haciendo parte de todos los organismos animales y vegetales.
De los minerales que contienen oxígeno, los más importantes son los que contienen silicio, siendo el más simple de todos la sílice (SiO2), que es el principal constituyente de la arena. Otros compuestos que contienen oxígeno son sulfatos, carbonatos, fosfatos, nitratos y óxidos, principalmente.

- Propiedades Físicas
En condiciones normales de presión y temperatura (STP), el oxigeno se encuentra en estado gaseoso formando moléculas diatónicas (O2). Al igual que el hidrógeno, no posee propiedades organolépticas, es decir es incoloro, inodoro e insípido.
El oxigeno se condensa a -183oC en un líquido azul pálido. Se solidifica a -219oC en un sólido blando azulado. Para ambos estados de agregación es muy paramagnético, es decir, sus regiones más probables de encontrar electrones u orbitales tienden a alinearse paralelamente cuando están en presencia de un campo magnético.
Si se suministra energía al oxígeno diatómico se obtiene la otra forma alotrópica del oxigeno conocida como ozono, de acuerdo con la reacción siguiente:
3Oo (g) → 2O3 (g)
La estructura de Lewis consideraba para el oxigeno presenta electrones sin pareja que violentan la regla del octeto, pero justifican el carácter paramagnético del oxígeno molecular, de acuerdo al cual el oxígeno es atraído por un campo magnético, tanto en su estado gaseoso como en estado líquido.
El ozono no es magnético, por tanto se le considera una estructura en la cual todos los electrones están apareados.
El ozono tiene un olor fuerte y penetrante. Éste es más soluble en agua que el oxigeno debido a que las moléculas del O3 son polares, sin embargo las del O2 no lo son.
Si llevamos el ozono a una temperatura de -111.5 oC se convierte en un líquido azul intenso de carácter fuertemente explosivo. El ozono es un agente oxidante fuerte. Sus aplicaciones se basan, precisamente, en su fuerte carácter oxidante.
El ozono se usa como germicida, como decolorante de ceras, féculas, grasas y barnices.
El oxigeno tiene tres isótopos estables y diez radiactivos. Los radioisótopos tienen todos una vida media de menos de tres minutos.
- PROPIEDADES QUÍMICAS
Existen equipos capaces de concentrar el oxígeno del aire. Son los llamados generadores o concentradores de oxígeno, que son los utilizados en los bares de oxígeno.
El oxígeno gaseoso no combinado suele existir en forma de moléculas diatómicas, O2, pero también existe en forma triatómica, O3, llamada ozono.
1. Es comburente.
2. Reacciona con los no metales para formar óxidos ácidos o anhídridos.
3. Reacciona con los metales para formar óxidos básicos.
4. Reacciona con muchos de sus compuestos.
1. Es comburente.
2. Reacciona con los no metales para formar óxidos ácidos o anhídridos.
3. Reacciona con los metales para formar óxidos básicos.
4. Reacciona con muchos de sus compuestos.

Oxígeno
| |
|
8
|
|
2
|
|
- 2
|
|
3,5
|
|
0,73
|
|
1,40
|
Radio atómico (Å) |
-
|
|
1s22s22p4
|
|
13,70
|
|
15,9994
|
|
1.429
|
|
-183
|
|
-218,8
|
|
Joseph Priestly 1774
|
- COMBUSTIÓN
En la combustión una sustancia química reacciona rápidamente con oxígeno produciendo calor y luz. Los productos típicos de una reacción de combustión son CO2, H2O, N2 y óxidos de cualquier otro elemento presente en la muestra original.
Los riesgos de fuego y explosión se dan cuando los oxidantes concentrados y los combustibles se sitúan demasiado cerca entre sí; sin embargo, la ignición, ya sea por el calor o por una chispa, es necesaria para iniciar la combustión.
El oxígeno en sí mismo no es un combustible, sino un oxidante. Los riesgos de la combustión también se aplican a compuestos de oxígeno de alto potencial oxidante, como los peróxidos, cloratos, nitratos, percloratos y dicromatos, porque pueden dar oxígeno al fuego.
Un ejemplo típico de combustión es la oxidación del metano según el proceso


La combustión es un proceso muy importante en nuestras vidas pues los combustibles se usan como fuente de energía, gasolina, gas, etc., en los medios de transportes, coches, aviones o en los hogares o industrias.
Un clave ejemplo de combustión es:
- En una fogata:

Se trata un montón de materia orgánica (por lo general leña, hojas secas, papel, etc.) amontonada para concentrar el calor y mantener viva la reacción, en contacto con el oxígeno y en presencia inicial de calor (un fósforo, por ejemplo).
- Una cocina a gas

Las cocinas domésticas operan en base a la combustión de un gas inflamable, por lo general una mezcla de propano (C3H8) y butano (C4H10), extraído de una cañería o de una bombona y puesto en contacto con el aire y con una carga inicial de energía calórica (como la llama del piloto).
- LA LLAMA
Es un fenómeno luminoso que se produce por la incandescencia de los gases durante la combustión.
Para que la llama comience y quede estable, se debe estabilizar el frente de llama. Para ello, se debe coordinar la velocidad de escape de gases y de propagación de la llama con la entrada de comburente (aire) y combustible. El frente de llama marca la separación entre el gas quemado y el gas sin quemar. Aquí es donde tienen lugar las reacciones de oxidación principales.
La propagación de la llama es el desplazamiento de ésta a través de la masa gaseosa. Se efectúa esta propagación en el frente de llama Si la combustión se efectúa con suficiente, oxígeno, es completa.
Si falta oxígeno, la combustión es incompleta y la temperatura que se alcanza es mas baja; en esta llama se reducen los óxidos de algunos metales; la llama que se produce tiene una luminosidad característica a causa de la incandescencia del carbón que no se quema por falta de oxígeno. Esta llama se conoce con el nombre de llama de reducción.
La forma que presenta una llama depende del medio técnico que prepara el combustible/comburente; es decir, depende del quemador utilizado, ya que éste es el encargado de pulverizar y repartir el combustible. Si la combustión es buena, la llama no será opaca, negruzca,... El color negro lo van a dar los inquemados.

- Zona interna o interior fría, corresponde a los gases que no entran en combustión, por lo que su temperatura es baja.
- Zona intermedia o de reducción, es una mezcla intermedia en la cual la combustión es incompleta y en la que se reducen los óxidos metálicos. La zona de reducción está generalmente limitada a una mera envoltura del cono interior.
- Zona exterior o de oxidación, que es la parte más externa de la llama y envuelve a las dos anteriores; por la abundancia de oxigeno hay combustión completa y la temperatura es más alta. El punto más caliente de la llama se encuentra en el interior de esta zona.
1) Llama de premezcla: La mezcla de los dos fluidos se realiza parcial o totalmente antes de alcanzar la cámara de combustión.
2) Llama de difusión: (sin mezcla previa) El combustible y el comburente se mezcla justo en el momento de la combustión.
- OBTENCIÓN
El oxígeno industrialmente se puedo obtener a partir de la destilación fraccionada del aire líquido. En este procedimiento llamado método de Georges Claude se desprende primero ázoe a -193° y luego el oxígeno a -181°.
Un método químico es el llamado método de Lavoisier el que consiste en el calentamiento de mercurio se oxida a 360° y luego se descompone el óxido.
Hg + O  HgO
HgO
En la industria se emplea el método de Boussingault, el cual consiste en el calentamiento de barita u óxido de bario (BaO) que se calienta al aire, al rojo naciente (400° aprox.), combinándose con el Oxigeno para formar bióxido de bario.
BaO + O 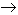 BaO2
BaO2
Calentando en seguida el bióxido de bario hacia 800°; se disocia en barita y oxígeno por la reacción inversa.
BaO2 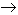 BaO + O
BaO + O
Teóricamente la barita puede servir indefinidamente pero en la práctica esto no sucede ya que el gas carbónico contenido en el aire produce carbonato de bario y por esto se debe renovar la barita periódicamente.
Se puede obtener oxígeno a partir de la electrólisis de agua alcalinizada con un 10 o 15% de NaOH. Los electrodos son de hierro. Todo se produce como si el agua estuviese descompuesta, y se recoge el oxígeno en el electrodo positivo y el hidrogeno en el electrodo negativo.
Métodos de laboratorio: Se descompone el agua oxigenada en presencia de un catalizador; se utiliza generalmente el bióxido de manganeso: MnO2.
H2O2 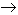 H2 O + O
H2 O + O
En lugar de utilizar H2O2, se puede utilizar el compuesto metálico correspondiente:
Na2O2 ó K2O2
Estos compuestos son destruidos por el agua:
H2O + K2O2 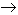 2KOH + O
2KOH + O
Se puede obtener oxígeno por calcinación de bióxido de manganeso y Clorato de potasio.
3MnO2 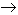 Mn3O4 + O2
Mn3O4 + O2
ClO3K 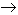 KCl + 3O
KCl + 3O
Realmente no se descompone el clorato de potasio completamente sino hasta una temperatura mucho mas elevada a una temperatura moderada la ecuación correspondiente es la siguiente:
2ClO3K 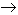 ClO4K + KCl + O2
ClO4K + KCl + O2
Para evitar este inconveniente generalmente se mezcla el clorato de potasio con bióxido de manganeso, en el cual el oxígeno se fija primero y luego inmediatamente lo abandona según las reacciones inversas:
2MnO2 + 3O 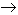 Mn2O7
Mn2O7
Mn2O7  2MnO2 + 3O
2MnO2 + 3O
- APLICACIONES Y USOS
El 55 % de la producción mundial de oxígeno se consume en la producción de acero. Otro 25 % se dedica a la industria química. Del 20 % restante la mayor parte se usa para aplicaciones medicinales, oxicorte, como oxidante en combustible de cohetes y en tratamiento de aguas.

- En la respiración
Las plantas, animales y los seres humanos dependen del oxígeno para respirar. El oxígeno inhalado penetra en los pulmones y alcanza los alvéolos. Las capas de células que revisten los alvéolos y los capilares circundantes se disponen ocupando el espesor de una sola célula y están en contacto estrecho unas con otras. Esta barrera entre el aire y la sangre tiene un grosor aproximado de una micra (1/10 000 cm). El oxígeno atraviesa rápidamente esta barrera aire–sangre y llega hasta la sangre que circula por los capilares. Igualmente, el dióxido de carbono pasa de la sangre al interior de los alvéolos, desde donde es exhalado al exterior.
- En la medicina
Los tratamientos son lo suficientemente flexibles como para ser usados en hospitales, la vivienda del paciente o, cada vez más, con instrumentos móviles. Así, las tiendas de oxígeno se solían usar como suplementos de oxígeno, pero han ido sustituyéndose por las máscaras de oxígeno y las cánulas nasales.
La medicina hiperbárica (de alta presión) usa cámaras especiales de oxígeno para aumentar la presión parcial del O2 en el paciente y, cuando son necesarias, en el personal médico.
La intoxicación por monóxido de carbono, la mionecrosis
(gangrena gaseosa) y el síndrome de descompresión a veces se tratan con estos aparatos. El aumento de la concentración del O2 en los pulmones ayuda a desplazar el monóxido de carbono del hemogrupo de hemoglobina.
El oxígeno es tóxico para la bacteria anaerobia que causa la gangrena gaseosa, de manera que aumentar su presión parcial ayuda a acabar con ellas.
También se usa oxígeno para pacientes que necesitan
ventilación mecánica, normalmente a concentraciones superiores al 21 % encontrado en el aire ambiental
- En el apoyo vital y uso recreativo
Una aplicación notable del O2 como gas respirable de baja presión se encuentra en los trajes espaciales modernos, que envuelven el cuerpo de sus ocupantes con aire presurizado. Estos dispositivos usan oxígeno casi puro a una presión de alrededor de un tercio de la común, lo que da como resultado una presión parcial normal en el O2 de la sangre.
Este intercambio de oxígeno de alta concentración para una baja presión es necesario para mantener la flexibilidad de los trajes espaciales.
Los buceadores y los tripulantes de submarinos también usan O2 artificialmente proporcionado, pero la mayoría usan una presión normal o una mezcla de oxígeno y aire. El uso de O2 puro o casi puro en buceo a presiones por encima del nivel del mar se limita generalmente a los descansos, descompresiones y tratamientos de emergencia a relativamente poca profundidad (~6 metros o menos).

Los escaladores de montaña y los que viajan en aviones no presurizados a veces tienen un suplemento de O2.
Los pasajeros de aviones comerciales (presurizados) tienen un suministro de O2 para emergencias, que les es puesto automáticamente a su disposición en caso de despresurización de la cabina. Una pérdida repentina de presión en la cabina activa generadores químicos de oxígeno sobre cada asiento y hace caer máscaras de oxígeno. Al tirar de la máscara para comenzar el flujo de oxígeno, tal y como indican las instrucciones de seguridad, se fuerzan las limaduras de hierro en el clorato de sodio dentro del recipiente.
- En la Industria
La fundición de mena de hierro en acero consume el 55 % del oxígeno producido comercialmente. En este proceso, el O2 es inyectado mediante una lanza de alta presión en el molde de hierro, que expulsa las impurezas de Azufre y el exceso de Carbono, en forma de sus respectivos óxidos, SO2 y CO2. Las reacciones son exotérmicas y la temperatura asciende hasta los 1700 Cº.

Otro 25 % de este oxígeno se dedica a la industria química. El etileno reacciona con el O2 para crear óxido de etileno, que, a su vez, se convierte en etilenglicol, el material usado como base para fabricar una gran variedad de productos, entre otros los anticongelantes y los polímeros de poliéster (los precursores de muchos plásticos y textiles).
El oxígeno se usa en el oxicorte quemando acetileno con O2 para producir una llama muy caliente. En este proceso, el metal de hasta 60 centímetros de grosor se calienta primero con una pequeña llama de oxiacetileno para después ser rápidamente cortado por un gran chorro de O2.
- En la Ciencia
Los paleoclimatólogos miden la relación entre el oxígeno-18 y el oxígeno-16 en los esqueletos y exoesqueletos de los organismos marinos para determinar cómo era el clima hace millones de años. Las moléculas de agua de mar que contienen el isótopo más ligero, el oxígeno-16, se evaporan a un ritmo ligeramente mayor que las moléculas que contienen oxígeno-18 (un 12 % más pesado); esta disparidad se incrementa a bajas temperaturas. En periodos con una temperatura global más baja, la nieve y la lluvia procedentes de esa agua evaporada tienden a ser más ricas en oxígeno-16, mientras que el agua marina que queda tiende a serlo en oxígeno-18. Los organismos marinos, por tanto, incorporan más oxígeno-18 en sus esqueletos y exoesqueletos de lo que harían en un medio más cálido. Los paleoclimatólogos también miden directamente esta relación en las moléculas de agua de muestras de núcleo de hielo que se han conservado durante varios cientos de miles de años.
Los geólogos planetarios han medido las diferencias en la abundancia de isótopos de oxígeno en muestras de la Tierra, la Luna, Marte y meteoritos, pero no han estado lejos de poder obtener valores de referencia para las relaciones entre isótopos del Sol, que se creen iguales a aquellas de la nebulosa protosolar. Sin embargo, el análisis de una oblea de Silicio expuesta al viento solar en el espacio y devuelta a la Tierra por la sonda Génesis desveló que el Sol tiene una proporción de oxígeno-16 mayor que nuestro planeta.
La medición implica que un proceso desconocido agotó el oxígeno-16 del disco protoplanetario del Sol antes de la fusión de los granos de polvo que formaron la Tierra.
Los geólogos planetarios han medido las diferencias en la abundancia de isótopos de oxígeno en muestras de la Tierra, la Luna, Marte y meteoritos, pero no han estado lejos de poder obtener valores de referencia para las relaciones entre isótopos del Sol, que se creen iguales a aquellas de la nebulosa protosolar. Sin embargo, el análisis de una oblea de Silicio expuesta al viento solar en el espacio y devuelta a la Tierra por la sonda Génesis desveló que el Sol tiene una proporción de oxígeno-16 mayor que nuestro planeta.
La medición implica que un proceso desconocido agotó el oxígeno-16 del disco protoplanetario del Sol antes de la fusión de los granos de polvo que formaron la Tierra.

El oxígeno presenta dos bandas de absorción
espectrofotométrica con máximos en longitudes de onda de 687 y 760 nanómetros.
HIDRÓGENO
MARCO TEÓRICO
MARCO TEÓRICO

- ESTADO NATURAL
El hidrógeno en estado libre sólo se encuentra en muy pequeñas cantidades en la atmósfera, aunque se estima que el 90% del universo visible esta compuesto de hidrógeno. En combinación con otros elementos se encuentra ampliamente distribuido en la Tierra, en donde el compuesto más abundante e importante del hidrógeno es el agua, H2O.
El hidrógeno se halla en todos los componentes de la materia viva y de muchos minerales. También es parte esencial de todos los hidrocarburos y de una gran variedad de otras sustancias orgánicas.
Todos los ácidos contienen hidrógeno; una de las características que define a los ácidos es su disociación en una disolución, produciendo iones hidrógeno
El hidrógeno es con mucho el elemento más abundante en el universo, pero es muy escaso en la Tierra. En términos de masa, este constituye sólo alrededor del 0.9% de la corteza terrestre, lo que lo coloca muy por abajo en la lista de los elementos abundantes. En términos de número de átomos sin embargo, el hidrógeno es muy abundante.
La mayor parte del hidrógeno de la Tierra se encuentra combinado con oxígeno, en forma de agua. Casi todos los compuestos derivados de los organismos vivos contienen H. Las grasas, almidones, azúcares y proteínas contienen hidrógeno. El petróleo y el gas natural también contienen mezclas de hidrocarburos (compuestos de hidrógeno y carbono).
El hidrógeno se encuentra en pequeñas cantidades en la atmósfera, así como en los gases que se desprenden de los volcanes y de los yacimientos de petróleo.
En combinación, por el contrario, el hidrógeno es bastante común: en el agua constituye en 11,2% de su peso total; el cuerpo humano, que es aproximadamente dos terceras partes de agua, tiene un 10% de hidrogeno por peso; forma parte esencial de todos los organismos animales y vegetales, en los cuales entra en combinación con oxígeno, nitrógeno, carbono, etc.
Finalmente, es un constituyente importante del petróleo y de los gases de combustibles naturales.
El hidrógeno se encuentra en pequeñas cantidades en la atmósfera, así como en los gases que se desprenden de los volcanes y de los yacimientos de petróleo.
En combinación, por el contrario, el hidrógeno es bastante común: en el agua constituye en 11,2% de su peso total; el cuerpo humano, que es aproximadamente dos terceras partes de agua, tiene un 10% de hidrogeno por peso; forma parte esencial de todos los organismos animales y vegetales, en los cuales entra en combinación con oxígeno, nitrógeno, carbono, etc.
Finalmente, es un constituyente importante del petróleo y de los gases de combustibles naturales.
- PROPIEDADES FÍSICAS
El hidrógeno es un gas incoloro, inodoro e insípido a temperatura ambiente.
Es el elemento más liviano que existe, siendo aproximadamente 14 veces menos pesado que el aire.
Su molécula consiste de dos átomos de hidrógeno (H2) unidos por un enlace covalente.
Posee tres isótopos, de los cuales el más abundante es el Protio (99.985%); el Deuterio tiene una abundancia de 0,02% y el tritio es tan escaso que de cada 109 átomos de hidrógeno hay uno de tritio.
El hidrogeno es fácilmente absorbido por ciertos metales finamente divididos, siendo los principales paladio, platino y oro.
Ejemplo:
Un volumen de paladio finamente dividido puede adsorber aproximadamente 850 volumen es de Hidrógeno a temperatura ambiente.
El hidrógeno absorbido es muy activo químicamente.
El hidrógeno absorbido es muy activo químicamente.
- PROPIEDADES QUÍMICAS
El hidrogeno es capaz de combinarse con la mayoría de los elementos cuando se tienen las condiciones adecuadas. El hidrógeno tiene gran afinidad con el oxígeno, con el cual se combina en frío muy lentamente, pero en presencia de una llama o de una chispa eléctrica lo hace casi instantáneamente con explosión. Por esto, las mezclas de hidrógeno y aire deben manejarse con mucha precaución.
La reacción es:
La reacción es:
La ecuación anterior nos indica la gran cantidad de energía desprendida por la reacción.
Una propiedad muy importante del hidrógeno es su poder reductor.
En efecto, a altas temperatura el hidrógeno reacciona con algunos óxidos reduciéndolos.
Este poder reductor, que se base en la tendencia del hidrógeno a oxidarse al estado de oxidación +1, tiene además aplicación en muchos procesos químicos.
Hidrógeno
| |
Número atómico
|
1
|
Valencia
|
1
|
| Estado de oxidación |
+1
|
Electronegatividad
|
2,1
|
Radio covalente (Å)
|
0,37
|
Radio iónico (Å)
|
2,08
|
Radio atómico (Å)
|
-
|
Configuración electrónica
|
1s1
|
Primer potencial de ionización (eV)
|
13,65
|
Masa atómica (g/mol)
|
1,00797
|
Densidad (g/ml)
|
0,071
|
Punto de ebullición (ºC)
|
-252,7
|
Punto de fusión (ºC)
|
-259,2
|
Descubridor
|
Boyle en 1671
|
- COMBUSTIÓN
El hidrógeno se combina con el oxígeno del aire para producir agua. Por ello, no crea problemas de emisión de gases de efecto invernadero como ocurre en el caso del petróleo, gas natural o incluso la biomasa.
Además, tiene una energía específica en su combustión de 120 MJ/kg, muy alta en comparación con los 50 MJ/kg del gas natural o los 44.6 MJ/kg del petróleo.
El gas hidrógeno (dihidrógeno) es altamente inflamable y se quema en concentraciones de 4 % o más H2 en el aire. La entalpía de combustión de hidrógeno es −285.8 kJ/mol; se quema de acuerdo con la siguiente ecuación balanceada.
2 H2(g) + O2(g) → 2 H2O(l) + 572 kJ (285.8 kJ/mol)
Cuando se mezcla con oxígeno en una variedad de proporciones, de hidrógeno explota por ignición. El hidrógeno se quema violentamente en el aire; se produce la ignición automáticamente a una temperatura de 560 °C.
Llamas de hidrógeno-oxígeno puros se queman en la gama del color ultravioleta y son casi invisibles a simple vista, como lo demuestra la debilidad de la llama de los motores principales del transbordador espacial (a diferencia de las llamas fácilmente visibles del cohete acelerador del sólido). Así que se necesita un detector de llama para detectar si una fuga de hidrógeno está ardiendo.
El hidrógeno está ubicado en el primer grupo y el primer período de la tabla periódica, es el primer elemento de la tabla periódica, convirtiéndolo en el elemento más liviano en el universo. El hidrógeno no es ni un metal ni un no metal pero aún es considerado un no metal. Actúa como un metal cuando es comprimido a altas densidades.
Dado que el gas de hidrógeno es tan ligero, se eleva en la atmósfera y por lo tanto raramente es encontrado en su forma pura, H2.1 En una llama de gas de hidrógeno puro, quemándose en el aire, el hidrógeno (H2) reacciona con el oxígeno (O2) para formar agua (H2O) y liberar calor.
- 2H2(g) + O2(g) → 2H2O(g)
Si se produce en el aire atmosférico en vez de oxígeno puro (como normalmente es el caso), la combustión del hidrógeno puede producir pequeñas cantidades de óxido de nitrógeno, junto con el vapor de agua.
- OBTENCIÓN
El hidrógeno se obtiene mediante diversos procesos:
- electrolisis
- reformado
- gasificación
- ciclos termoquímicos
- producción biológica
ELECTROLISIS
Es un proceso que consiste en la descomposición del agua a través de la utilización de la electricidad. Este proceso industrial tiene sus ventajas, pues es fácilmente adaptable ya sea para grandes o pequeñas cantidades de gas, consiguiéndose un hidrógeno de gran pureza. La electrolisis también posee la ventaja de poder combinarse y relacionarse de manera óptima con las energías renovables con el fin de producir H2.

REFORMADO
Consiste en la reacción de los hidrocarburos con la presencia de calor y vapor de agua. Dicho método permite producir grandes cantidades de hidrógeno con un bajo coste, partiendo del gas natural. Como desventaja de éste método, podemos decir, que a pequeña escala no es muy rentable ni comercial, y el hidrógeno producido suele contener impurezas, siendo incluso en ciertas ocasiones necesaria la limpieza posterior, o la realización de reacciones secundarias, con el fin de intentar purificar el producto de hidrógeno. Se suele relacionar fácilmente con la fijación del CO2, o almacenamientos de carbono, lo que hace que las emisiones del CO, incluido su proceso de fijación, supongan un problema para este método, pues genera una serie de costes adicionales.
GASIFICACIÓN
El hidrógeno a través del proceso de gasificación, se obtiene a partir de hidrocarburos pesados y la biomasa, obteniéndose además del hidrógeno, gases para reformado, a partir de las reacciones del vapor de agua y el oxígeno.
Este método es muy adecuado cuando se trata de hidrocarburos a gran escala, pudiendo ser usados el carbón, los combustibles sólidos, y líquidos.
El hidrógeno obtenido por gasificación, presenta semejanzas con otros derivados sintéticos de la biomasa, produciendo competencia entre ellos. La gasificación de la biomasa es aún hoy en día objeto de estudio, y posee implicaciones y limitaciones pues necesita grandes extensiones de terreno.

CICLOS TERMOQUÌMICOS
Este proceso utiliza el calor de bajo coste producido de la alta temperatura que procede de la energía nuclear o también de la energía solar concentrada.
Este proceso utiliza el calor de bajo coste producido de la alta temperatura que procede de la energía nuclear o también de la energía solar concentrada.
Es un proceso bastante utilizable y atractivo cuando se habla de gran escala, al tener bajo coste económico, y no emitiendo gases de carácter invernadero, pudiendo ser usado en la industria pesada o incluso en el transporte. Existen distintos proyectos de colaboraciones internacionales para investigar y desarrollar este método. Hoy en día, aún falta mayor investigación sin fines comerciales.
- APLICACIONES Y USOS
- Elevadas cantidades de hidrógeno son necesarias en industrias químicas y petrolíferas, en el bien conocido proceso de “Harber” para la producción de amoniaco, el quinto compuesto que presenta la mayor producción industrial actual.
- Además del amoníaco, el hidrógeno también es utilizado en la hidrogenación de la grasa y aceites, hidroalquilaciones, hidrosulfuración, hidrockacking, así como en la producción de metanol.
- El H2 se utiliza como un agente hidrogenizante, particularmente en el aumento del nivel de saturación de las grasas y aceites insaturados
- Además de su uso como un reactivo, H2 tiene amplias aplicaciones en la física y la ingeniería. Se utiliza como gas de protección en los métodos de soldadura tales como la soldadura de hidrógeno atómico.
- El H2 se utiliza como un enfriador de generadores en
centrales eléctricas, porque tiene la mayor conductividad térmica de todos los gases.
- H2 líquido se utiliza en la investigaciones criogénicas, incluyendo estudios de superconductividad.
- Se utiliza hidrógeno puro o mezclado con nitrógeno como gas indicador para detectar fugas.
- El H2 también se utiliza como agente reductor de minerales
metálicos.
CONCLUSIONES
- El hidrógeno es uno de los elementos con mayor importancia en nuestro día a día. Existen átomos de hidrógeno en cada molécula de agua y una muy buena parte de los átomos que constituyen las moléculas que soportan la vida son de hidrógeno.
- El hidrógeno también es utilizado en la hidrogenación de la grasa y aceites, hidroalquilaciones, hidrosulfuración, hidrockacking, así como en la producción de metanol entre otras.
- La reacción del hidrógeno con el oxígeno, para producir agua realizada en células de combustibles es una de las formas más promisoras para generar energía para automóviles, evitando la liberación de gases con efecto invernadero, al contrario de lo que sucede con los motores actuales que utilizan la combustión de hidrocarburos de origen fósil.
- Sin oxígeno es imposible vivir, siendo necesario para la respiración de los Seres Vivos, no solo en lo que respecta en la Respiración Pulmonar de los animales y las personas, sino también lo relativo a la Respiración Celular que permite su nutrición, formación de nuevas células y todo lo relativo al Funcionamiento Celular.
WEBGRAFÍA
https://www.ecured.cu/Oxígeno
https://es.wikipedia.org/wiki/Hidrógeno
https://www.enciclopediadetareas.net/2010/09/estado-natural-del-oxigeno.html
https://www.lenntech.es/periodica/elementos/o.htm
https://www.textoscientificos.com/quimica/oxigeno
https://es.wikipedia.org/wiki/Oxígeno#Usos_y_aplicaciones
https://www.monografias.com/trabajos34/hidrogeno/hidrogeno.shtml#estado
https://www.enciclopediadetareas.net/2010/09/propiedades-fisicas-y-quimicas-del.html
https://www.lenntech.es/periodica/elementos/h.htm#ixzz5xgPpLdM5
https://www.eoi.es/blogs/beatrizsarrion/2014/01/27/el-hidrogeno-como-combustible/
https://es.wikipedia.org/wiki/Hidrógeno#Combustión
https://es.wikipedia.org/wiki/Hidrógeno#Aplicaciones
https://www.lenntech.es/periodica/elementos/h.htm#ixzz5xgPpLdM5
https://www.eoi.es/blogs/beatrizsarrion/2014/01/27/el-hidrogeno-como-combustible/
https://es.wikipedia.org/wiki/Hidrógeno#Combustión
https://es.wikipedia.org/wiki/Hidrógeno#Aplicaciones


BUEN TRABAJO 4,7
ResponderEliminar