GASES
ERIKA LORENA VALENCIA MARTINEZ
10-1
INSTITUCIÓN EDUCATIVA TÉCNICA EXALUMNAS DE LA PRESENTACIÓN
ERIKA LORENA VALENCIA MARTINEZ
10-1
INSTITUCIÓN EDUCATIVA TÉCNICA EXALUMNAS DE LA PRESENTACIÓN
IBAGUE - TOLIMA
QUÍMICA
2019
INTRODUCCIÓN
A continuación trataremos sobre un tema los gases, sus propiedades físicas, químicas y sus respectivas leyes, teniendo en cuenta que estos gases no tienen forma en especifica. Ademas, es un estado de agregación de la materia en el que las sustancias no tienen forma ni volumen propio, adoptando el de los recipientes que las contienen. Las moléculas que constituyen un gas casi no son atraídas unas por otras, por lo que se mueven en el vacío a gran velocidad y muy separadas unas de otras.
Por otra parte, existen diversos modelos que relacionan la presión, la temperatura y el volumen de un gas, por lo que hay una leyes en el que se refleja la relación entre estas: Las leyes de los gases
La ley de Charles, establece que el volumen y la temperatura son directamente proporcionales cuando la presión es constante.
La ley de Boyle, afirma que la presión y el volumen son inversamente proporcionales entre sí la temperatura constante.
La ley de Gay-Lussac, introduce una proporcionalidad directa entre la temperatura y la presión, siempre y cuando se encuentre a un volumen constante.
La interdependencia de estas variables se muestra en la ley de los gases combinados, que establece claramente que:
La relación entre el producto presión-volumen y la temperatura de un sistema permanece constante.
OBJETIVOS GENERALES
- Conocer y aprender el concepto de gases
- Caracterizar las propiedades y generalidades de los gases
- Identificar las formulas que emplean las diversas leyes de los gases
- Recopilar la información presentada de los gases y tener en cuenta las distintas aplicaciones con las que se llevan a cabo
OBJETIVOS ESPECÍFICOS
- Diferenciar las distintas leyes de los gases
- Identificar la importancia de los gases y sus aplicaciones en la vida cotidiana.
- Reconocer de forma interactiva el concepto y el proceso de un gas mediante sus respectivas leyes.
MARCO TEÓRICO
LOS GASES: son un al estado de agregación de la materia en el cual, bajo ciertas condiciones de temperatura y presión, sus moléculas interaccionan débilmente entre sí, sin formar enlaces moleculares, adoptando la forma y el volumen del recipiente que las contiene y tendiendo a separarse, esto es, expandirse, todo lo posible por su alta concentración de energía cinética.
Los gases son fluidos altamente compresibles, que experimentan grandes cambios de densidad con la presión y la temperatura.
Las moléculas que constituyen un gas casi no son atraídas unas por otras, por lo que se mueven en el vacío a gran velocidad y muy separadas unas de otras, explicando así las propiedades:
- Las moléculas de un gas se encuentran prácticamente libres, de modo que son capaces de distribuirse por todo el espacio en el cual son contenidos. Las fuerzas gravitatorias y de atracción entre las moléculas son despreciables, en comparación con la velocidad a la que se mueven sus moléculas.
- Los gases ocupan completamente el volumen del recipiente que los contiene.
- Los gases no tienen forma definida, adoptando la de los recipientes que las contiene.
- Pueden comprimirse fácilmente, debido a que existen enormes espacios vacíos entre unas moléculas y otras.
- Sus partículas se encuentran en un estado casi libre (también se denomina gas al proceso de digestión del ser humano).
A temperatura y presión ambientales los gases pueden ser elementos como el hidrógeno, el oxígeno, el nitrógeno, el cloro, el flúor y los gases nobles, compuestos como el dióxido de carbono o el propano, o mezclas como el aire.
Los vapores y el plasma comparten propiedades con los gases y pueden formar mezclas homogéneas, por ejemplo vapor de agua y aire, en conjunto son conocidos como cuerpos gaseosos, estado gaseoso o fase gaseosa.
GENERALIDADES DE LOS GASES
Los gases representan uno de los tres estados comunes de la materia: sólido, liquido, y gaseoso. Hay muchas sustancias que pueden existir en los tres estados, el agua por ejemplo, puede existir como liquido, solido (hielo) o gas (vapor de agua).
Otros ejemplos son los gases oxígeno y nitrógeno, que se convierten en líquido a temperaturas muy bajas; al bajar aún mas esta temperatura alcanzan el estado sólido.
El gas se define como un estado de la materia, que se puede expandir indefinidamente y que toma la forma del recipiente que lo contiene, ocupando todo el espacio disponible de dicho contenedor. En este sentido, los sólidos y los líquidos se diferencian de los gases en que los sólidos tiene su forma y volúmenes propios, y los líquidos adquieren la forma del recipiente que los contiene pero tienen volumen propio.
Los gases tienen cinco propiedades físicas fundamentales que los hacen a la vez útiles y potencialmente peligrosos. Estas características son:
- Los gases son mucho más ligeros que los líquidos y los sólidos.
- Las moléculas de los gases siempre están en movimiento.
- Los gases, en caso de fuga, se distribuirán eventualmente por sí mismos a través del aire en una habitación u otro espacio cerrado.
- Algunos gases tienen olor y otros no.
- La mayoría de los gases son invisibles, aunque algunos si son visibles.
PROPIEDADES
FÍSICAS
- Los gases ocupan completamente el volumen del recipiente que los contiene.
- Los gases no tienen forma definida, adoptando la de los recipientes que las contiene.
- Debido al enorme espacio que hay entre unas y otras se comprimen fácilmente, es decir pueden pasar de ocupar cierto volumen a uno menor tamaño.
- Se dilatan y contraen como los sólidos y líquidos.
- Fluidez: Es la propiedad que tiene un gas para ocupar todo el espacio debido a que, prácticamente, no posee fuerzas de unión entre las moléculas que lo conforman.
- Difusión: Es el proceso por el cual un gas se mezcla con otro debido únicamente al movimiento de sus moléculas.

- Compresión: La compresión es la disminución del volumen de un gas porque sus moléculas se acercan entre sí, debido a la presión aplicada.
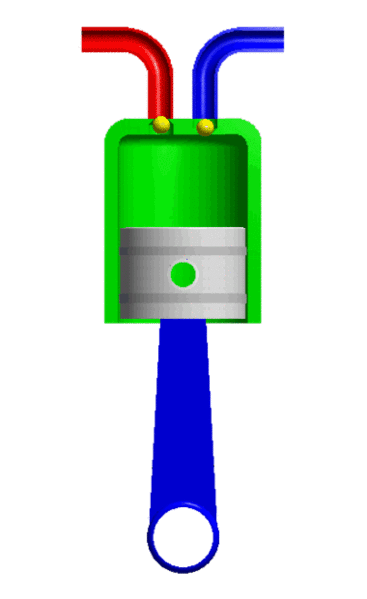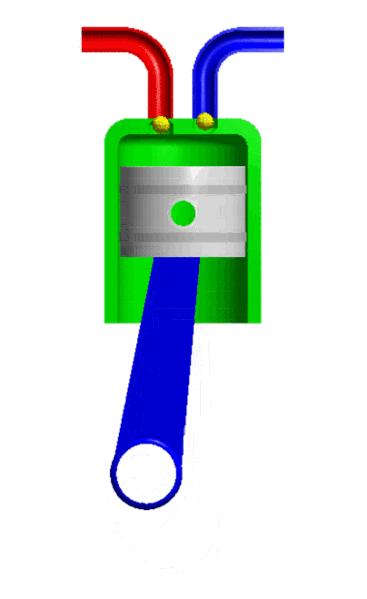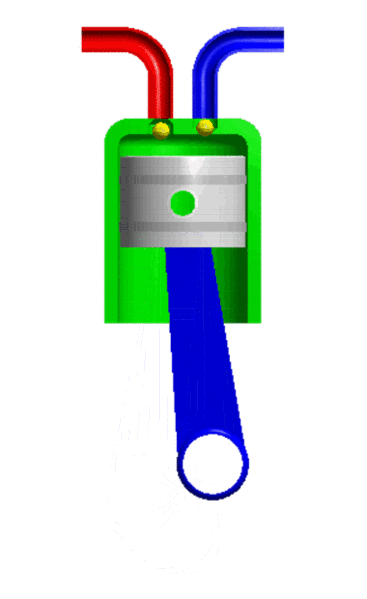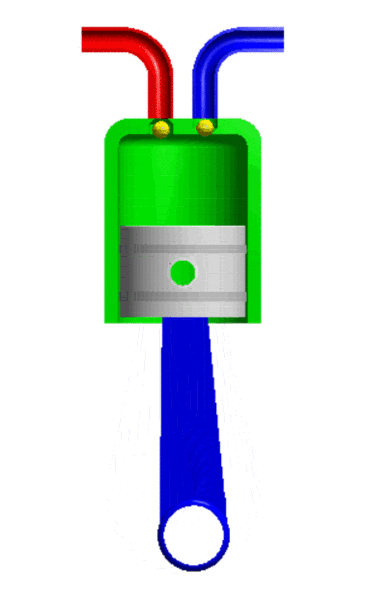

- Resistencia: Es la propiedad de los gases de oponerse al movimiento de los cuerpos por el aire. Esto se debe a una fuerza llamada fuerza roce. A mayor tamaño y velocidad del cuerpo mayor es la resistencia.

QUIMICAS
- Las moléculas de un gas se encuentran prácticamente libres, de modo que son capaces de distribuirse por todo el espacio en el cual son contenido.
- Las fuerzas gravitatorias y de atracción entre las moléculas son despreciables, en comparación con la velocidad a que se mueven sus moléculas. Pueden comprimirse fácilmente, debido a que existen enormes espacios vacíos entre unas moléculas y otras.
- Se dilatan, la energía cinética promedio de sus moléculas es directamente proporcional a la temperatura aplicada.
- A temperatura y presion ambientales los gases pueden ser elementos como el hidrogeno, el oxigeno, el nitrogeno, el cloro, el fluor, y los gases nobles, compuestos como el dioxido de carbono o propano, o mezclas como el aire.
Las primeras leyes de los gases fueron desarrollados desde finales del siglo XVII, cuando los científicos empezaron a darse cuenta de que en las relaciones entre la presión, el volumen y la temperatura de una muestra de gas, en un sistema cerrado, se podría obtener una fórmula que sería válida para todos los gases. Estos se comportan de forma similar en una amplia variedad de condiciones, debido a la buena aproximación que tienen las moléculas que se encuentran más separadas, y hoy en día la ecuación de estado para un gas ideal se deriva de la teoría cinética. Ahora las leyes anteriores de los gases se consideran como casos especiales de la ecuación del gas ideal, con una o más de las variables mantenidas constantes.
Empíricamente, se observan una serie de relaciones proporcionales entre la temperatura, la presión y el volumen que dan lugar a la ley de los gases ideales, deducida por primera vez por Émile Clapeyron en 1834.
Las leyes de los gases tienen unos parámetros que se deben tener en cuenta y son:
PARÁMETROS DE LAS LEYES DE LOS GASES
- Presión: es la cantidad de fuerza aplicada sobre una superficie. La unidad de presión en SI es el pascal (Pa) pero para el análisis matemático de las leyes de los gases se usa la unidad de atmósfera (atm); 1 atm es igual a 101325 Pa.
- Volumen: es el espacio ocupado por una cierta cantidad de masa y se expresa en litros (L).
- Temperatura: es la medida de la agitación interna de las partículas de gas y se expresa en unidades kelvin (K). Para transformar centígrados a kelvin, sólo tenemos que sumar 273.
- Moles: es la cantidad de masa del gas . Se representa con la letra n y sus unidades son moles.
- Gas ideal: Un gas ideal es un gas teórico compuesto de partículas que se mueven al azar y que no interactúan entre ellas. Los gases en general se comportan de manera ideal cuando se encuentran a altas temperaturas y bajas presiones. Esto es debido a la disminución de las fuerzas intermoleculares. Cuando un gas se encuentra a muy baja temperatura y/o bajo condiciones de presión extremadamente altas ya no se comporta de forma ideal. Bajo estas condiciones las leyes de los gases no se cumplen.
- Condición estándar: Nos referimos a condiciones estándar cuando una sustancia se encuentra a 1 atm de presión y 273 K de temperatura (es decir, 0ºC) tiene un volumen de 22,4 L por mol de sustancia.
Las leyes de los gases son un conjunto leyes químicas y físicas que
permiten determinar el comportamiento de los gases en un sistema cerrado.
Existen diversas leyes derivadas de modelos simplificados de la realidad que relacionan la presión, el volumen y la temperatura de un gas.
LEY DE BOYLE
Boyle descubrió en 1662 que la presión que ejerce un gas es inversamente proporcional a su volumen a temperatura y cantidad de gas constante: P = k / V → P · V = k (k es una constante).
Es una de las leyes de los gases que relaciona el volumen y la presión de una cierta cantidad de gas mantenida a temperatura constante. La ley dice que a una temperatura constante y para una masa dada de un gas el volumen del gas varía de manera inversamente proporcional a la presión absoluta del recipiente:
Matemáticamente se puede expresar así:
donde es constante si la temperatura y la masa del gas permanecen constantes.
- Cuando aumenta la presión el volumen baja, mientras que si la presión disminuye el volumen aumenta. No es necesario conocer el valor exacto de la constante para poder hacer uso de la ley: si consideramos las dos situaciones de la figura, manteniendo constante la cantidad de gas y la temperatura, deberá cumplirse la relación:
donde:
Además, si se despeja cualquier incógnita se obtiene lo siguiente:
La presión absoluta y el volumen de una masa dada de un gas confinado son inversamente proporcional, mientras la temperatura no varíe dentro de un sistema cerrado.
Lo cual tiene como consecuencia que:
Lo cual tiene como consecuencia que:
- Si la presión aumenta el volumen disminuye
- Si la presión disminuye el volumen aumenta

EJEMPLO
Si el gas en una jeringa está originalmente a 1 atm y el volumen es 5 mL, luego presión por volumen (PV) sera igual 5 atm-mL. Si el émbolo se empuja hasta reducir el volumen de 2,5 mL, entonces la presión tendrá que aumentar hasta 2 atm, de manera de mantener constante PV.

Al aumentar la presión sobre un gas, manteniendo la temperatura y la masa constante, el volumen disminuye.
LEY DE CHARLES
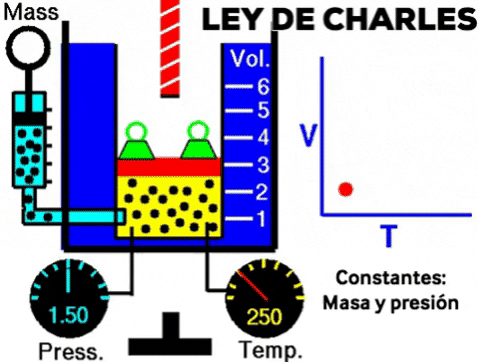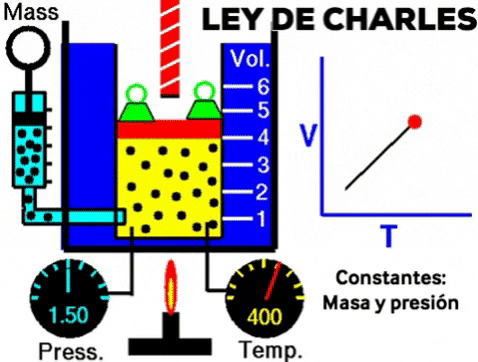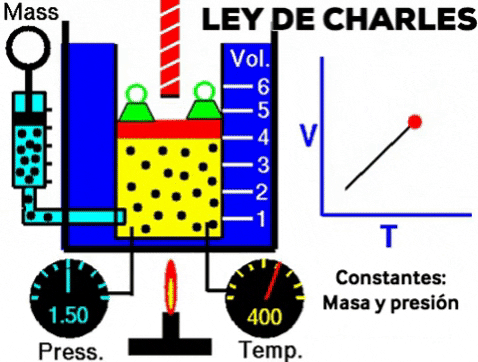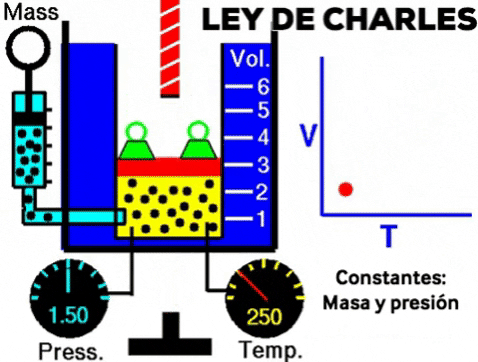


Cuando se calienta un gas, manteniendo la presión y la cantidad de moléculas, el volumen del gas aumenta.
A presión constante, el volumen de una dada cantidad de un gas ideal aumenta al aumentar la temperatura.
A una presión dada, el volumen ocupado por una cierta cantidad de un gas es directamente proporcional a su temperatura.
Matemáticamente la expresión sería:
o .
en términos generales:
Cuando se aplica la ley de Charles, se debe usar la temperatura absoluta. Para convertir la temperatura de ºC a kelvin (K) se suma 273.
Lo cual tiene como consecuencia que:



Lo cual tiene como consecuencia que:
- Si la temperatura aumenta el volumen aumenta
- Si la temperatura disminuye el volumen disminuye

EJEMPLO
Una llanta de un vehículo se llena con 100 L (V1) de aire a 10ºC. Luego de rodar varios kilómetros la temperatura sube a 40ºC (T2) ¿Cuánto será el volumen de aire (V2) en la llanta?
LEY DE GAY-LUSSAC

La presión de una cierta cantidad de gas, que se mantiene a volumen constante, es directamente proporcional a la temperatura:
Al aumentar la temperatura de un gas confinado en un recipiente, aumenta la energía cinética de las moléculas del gas y, como consecuencia, las colisiones con las paredes del contenedor. El aumento de la frecuencia de colisiones resulta en el aumento de la presión. En utensilios como las ollas de presión y las teteras existen válvulas de seguridad que permiten la liberación de forma segura la presión antes de que alcance niveles peligrosos.
 Lo cual tiene como consecuencia que:
Lo cual tiene como consecuencia que:
EJEMPLO

- Si la temperatura aumenta la presión aumenta
- Si la temperatura disminuye la presión disminuye
EJEMPLO
Si la presión y la temperatura del aire en una jeringa estan originalmente a 1,0 atm y 293 K y se coloca la jeringa en agua hirviendo, la presión aumentará a 1,27 atm, según los siguientes cálculos:
LEY COMBINADA DE LOS GASES IDEALES
La Ley General de los Gases consiste en la unión de las siguientes leyes:
- Ley de Boyle: P1 · V1 = P2 · V2
- Ley de Gay-Lussac: P1 / T1 = P2 / T2
- Ley de Charles: V1 / T1 = V2 / T2
Combinando las tres leyes anteriores se obtiene:
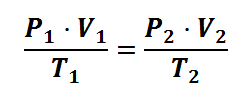
- P1 = 650 mmHg
- V1 = 670 ml = 0,67 litros
- T1 = 100ºC = 373ºK
- P2 = ?
- V2 = 1,5 litros
- T2 = 200ºC = 473ºK
Despejamos P2 :
- P2 = (P1 · V1 / T1 ) · (T2 / V2)
- P2 = (650 · 0,67 / 373) · (473 / 1,5) = 368 mmHg
LEY DE LOS GASES IDEALES
La ley de gases ideales conjuga las leyes de Boyle, Charles, Gay-Lussac y Avogadro, relacionando las cuatro cantidades: presión, volumen, temperatura y moles.
La ley de los gases ideales se expresa matemáticamente como:
ó
En esta ecuación, R representa la constante de la ley de los gases ideales. También se puede expresar como:
R tiene un valor de:
Los gases ideales poseen las siguientes propiedades:
- Las moléculas del gas se mueven a grandes velocidades de forma lineal pero desordenada
- La velocidad de las moléculas del gas es proporcional a su temperatura absoluta
- Las moléculas del gas ejercen presión sostenida sobre las paredes del recipiente que lo contiene
- Los choques entre las moléculas del gas son elásticas por lo que no pierden energía cinética
- La atracción / repulsión entre las moléculas del gas es despreciable.
EVIDENCIAS DEL LABORATORIO
DIÓXIDO DE CARBONO
HIDRÓGENO
OXIGENO
LEYES DE LOS GASES
LEY DE BOYLE
LEY DE CHARLES
CONCLUSIONES
- La ley de boyle, establece que la presión de un gas es un recipiente cerrado es inversamente proporcional al volumen del recipiente.
- La ley de Gay-Lussac establece que una relación entre el presión y la temperatura de un gas ideal, manteniéndolo a un volumen constante, por medio de una constante de proporcionalidad directa.
- Esta ley nos dice que cuando hay un volumen constante, al aumentar la temperatura, la presión del gas aumenta y cuando se disminuye la temperatura, presión del gas disminuye.
- La ley de Charles comprueba que el volumen de un gas es directamente proporcional a su temperatura absoluta.
WEBGRAFÍA
- https://es.wikipedia.org/wiki/Gas
- https://es.wikipedia.org/wiki/Ley_general_de_los_gases
- http://corinto.pucp.edu.pe/quimicageneral/contenido/521-leyes-de-los-gases-ideales.html
- https://es.scribd.com/document/354972903/Generalidades-Gases
- https://profesorparticular68.wordpress.com/propiedades-fisicas-de-los-gases/
- https://www.portaleducativo.net/biblioteca/gases_propiedad_fluidez.jpg
- https://www.portaleducativo.net/octavo-basico/794/Propiedades-de-los-gases
- https://www.todamateria.com/leyes-de-los-gases/
- https://es.wikipedia.org/wiki/Gas#Leyes_de_los_gases
- https://www.quimicas.net/2015/06/leyes-de-los-gases.html
- http://naturafisicos.blogspot.es/1391401562/aplicaciones-de-la-ley-de-charles/
- https://www.euston96.com/ley-de-charles/














NO HIZO EL INFORME DE LA CHARLA 3,3
ResponderEliminar